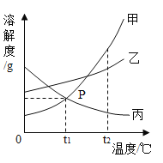
题目内容
【题目】小芳做探究性实验:用称量法测定铁在O2燃烧的产物。发现5.6g铁在足量的O2中燃烧得到7.82g固体。小芳排除了其他因素可能产生的误差,则她得到的固体产物可能是(___)
A .Fe3O4和Fe的混合物 B.Fe3O4和FeO的混合物
C. Fe3O4和Fe2O3的混合物 D.____________________
【答案】C Fe3O4、Fe2O3、FeO
【解析】
设5.6g铁完全燃烧生成四氧化三铁的质量为x,则有:
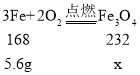
![]() 解得x=7.7g
解得x=7.7g
而实际上得到的固体质量为7.82g>7.7g,说明生成的另一物质的含氧量比四氧化三铁的含氧量高,将Fe3O4、Fe2O3、FeO中的铁原子个数定为1得:FeO4/3 、FeO3/2 、FeO。由式子可知Fe2O3中氧元素的含量最高,故C正确。即Fe2O3>Fe3O4>FeO,所以固体产物可能是Fe3O4、Fe2O3的混合物。也可能是Fe3O4、Fe2O3、FeO三种的混合物。
故答案为:C,Fe3O4、Fe2O3、FeO

 阅读快车系列答案
阅读快车系列答案【题目】在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请你参与他们的探究并回答问题。
(查阅资料)铜和氧化铁是红色固体,铁粉是黑色固体。
(1)(提出问题)
假设1:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;假设3:红色粉末是___。
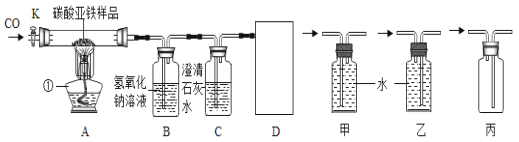
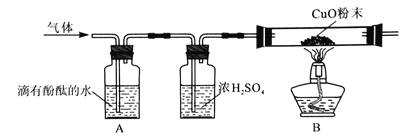
(设计实验方案)同学们对实验作了如下设想和取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如图所示)。
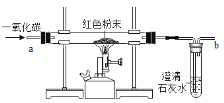
请你完成下表:
实验中可能出现的现象 | 结论 |
A红色粉末_______,石灰水_____ | 假设1成立 |
B红色粉末_________,石灰水变浑浊 | 假设2成立 |
C红色粉末部分变黑。石灰水________ | 假设3成立 |
(进行实验)通过实验及分析,确认假设3成立。
(2)(反思与评价)
①实验过程中,硬质玻璃管内发生反应的化学方程式是____。
②实验时通入一氧化碳片刻后再加热的原因是_____。
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是___。
(3)(拓展)为了把实验结束后的铜粉和铁粉分离开来,你认为可选用____(填序号)
A 过滤 B 用磁铁吸引 C 在空气中灼烧