题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质),某课题组以此粉末为原料进行资源回收,其工艺流程如下:
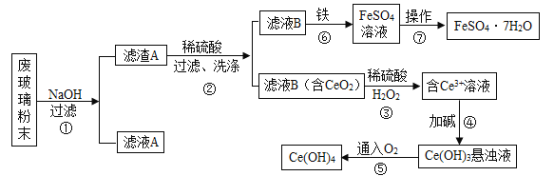
(1)写出第②步反应的化学方程式__________。
(2)洗涤滤渣B的目的是为了除去_____(填离子符号)。
(3)第③步反应中Ce元素由_______价变成+3价。
(4)第⑦步操作是把FeSO4溶液经蒸发浓缩、________、过滤、洗涤、干燥等步骤得到绿矾FeSO4·7H2O。
(5)若第④步加的碱为NaOH溶液,写出生成Ce(OH)3的反应方程式_________。
(6)请补充完整第⑤步反应的化学方程式:4Ce(OH)3+O2+_____=4Ce(OH)4。
【答案】Fe2O3+3H2SO4═Fe2(SO4)3+3H2O Fe3+ +4 降温结晶 Ce2(SO4)3+6NaOH═2Ce(OH)3↓+3Na2SO4 2H2O
【解析】
(1)根据流程图可知SiO2、Fe2O3、CeO2等物质中,二氧化硅和氢氧化钠反应反应,后面的滤渣B中提示有CeO2,所以第②步反应应该是氧化铁和硫酸反应生成硫酸铁和水,对应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)滤渣B是硫酸铁和固体分离得到的,所以洗涤滤渣B的目的是为了除去硫酸铁,对应的也就是除去 Fe3+;
(3)第③步反应中,是由CeO2转化为 Ce3+所以Ce元素由+4价变成+3价;
(4)第⑦步操作是把FeSO4溶液经蒸发浓缩、降温结晶、过滤、洗涤、干燥等步骤得到绿矾FeSO47H2O;
(5)若第④步加的碱为NaOH溶液,根据给出的信息可知生成了Ce(OH)3,根据复分解反应特征,可知生成Ce(OH)3,反应方程式为:Ce2(SO4)3+6NaOH═2Ce(OH)3↓+3Na2SO4;
(6)根据质量守恒定律和化学方程式4Ce(OH)3+O2+( )=4Ce(OH)4,可知反应前缺少4个氢原子和2个氧原子,所以为两分子水,对应的符号为:2H2O。

 名题金卷系列答案
名题金卷系列答案