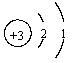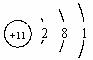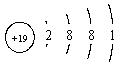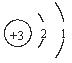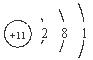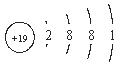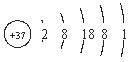题目内容
下表列出了四种金属元素的原子结构及单质的性质等具体情况:
| 元素 名称 | 元素 符号 | 原子结构示意图 | 密度 g/cm3 | 熔点/℃ | 沸点/℃ | 与冷水反应 |
| 锂 | Li | 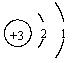 | 0.534 | 180.5 | 1347 | 剧烈 |
| 钠 | Na | 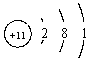 | 0.97 | 97.81 | 882.9 | 剧烈 |
| 钾 | K | 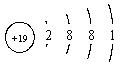 | 0.86 | 63.65 | 774 | 剧烈 轻微爆炸 |
| 铷 | Rb | 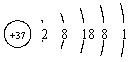 | 1.532 | 38.39 | 688 | 剧烈 轻微爆炸 |
(1) ;
(2) ;
(3) ;
(4)上表所列规律中,有一种规律是决定其它规律的,该规律是:
。
(1)对同一族元素随着核电荷数的增大,电子层数逐渐增加;
(2)对同一族元素随着核电荷数的增大,一般说来单质的密度逐渐增大,溶、沸点逐渐降低;
(3)对同一族元素随着核电荷数的增大,单质的化学活泼性逐渐增强;
(4)随着核电荷数的增大,电子层数逐渐增加。
解析试题分析:从图中可看出,(1)从上到下,随着核电荷数的增加,4种金属元素原子的电子层数逐渐增加;(2)4种金属单质的密度,从0.534~1.532g/cm3逐渐增大;(3)4种金属单质的熔点,从180.5℃~38.39℃,沸点从1347℃~688℃逐渐降低;(4)4种金属单质和冷水反应的剧烈程度,逐渐增加。
从图中可看出,4种金属元素的最外层电子数相同,而其电子层数不同;再结合上面的分析可判断,上述其它规律是由“随着核电荷数的增大,电子层数逐渐增加”,这一规律决定的。
考点:元素周期表的特点及其应用,核外电子在化学反应中的作用
点评:本题主要考查的是最外层电子数相同但电子层数不同的原子从上到下的变化规律,难度不大,只是叙述规律时要注意语言的规范性和完整性。

 53随堂测系列答案
53随堂测系列答案下表列出了四种金属元素的原子结构及单质的性质等具体情况:
| 元素 名称 | 元素 符号 | 原子结构示意图 | 密度 g/cm3 | 熔点/℃ | 沸点/℃ | 与冷水反应 |
| 锂 | Li |
| 0.534 | 180.5 | 1347 | 剧烈 |
| 钠 | Na |
| 0.97 | 97.81 | 882.9 | 剧烈 |
| 钾 | K |
| 0.86 | 63.65 | 774 | 剧烈 轻微爆炸 |
| 铷 | Rb |
| 1.532 | 38.39 | 688 | 剧烈 轻微爆炸 |
根据以上资料分析,你发现了哪些规律?
(1) ;
(2) ;
(3) ;
(4)上表所列规律中,有一种规律是决定其他规律的,该规律是:
下表列出了四种金属元素的原子结构及单质的性质等具体情况:
| 元素 名称 | 元素 符号 | 原子结构示意图 | 密度 g/cm3 | 熔点/℃ | 沸点/℃ | 与冷水反应 |
| 锂 | Li |
| 0.534 | 180.5 | 1347 | 剧烈 |
| 钠 | Na |
| 0.97 | 97.81 | 882.9 | 剧烈 |
| 钾 | K |
| 0.86 | 63.65 | 774 | 剧烈 轻微爆炸 |
| 铷 | Rb |
| 1.532 | 38.39 | 688 | 剧烈 轻微爆炸 |
根据以上资料分析,你发现了哪些规律?
(1) ;
(2) ;
(3) ;
(4)上表所列规律中,有一种规律是决定其他规律的,该规律是:
。