题目内容
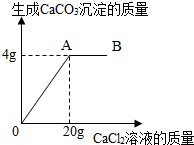 碳酸钠和氯化钠的混合物14g,常温溶解在足量70g水中,向溶液中逐滴加入氯化钙溶液.加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图.请回答:
碳酸钠和氯化钠的混合物14g,常温溶解在足量70g水中,向溶液中逐滴加入氯化钙溶液.加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图.请回答:(1)图象中表示恰好完全反应的点是
(2)求原混合物中氯化钠的质量.
(3)求反应后溶液的溶质质量分数.(精确到0.01%)
分析:(1)欲知图象中表示恰好完全反应的点,应观察图象中从何时开始生成物不再增加;
(2)根据化学方程式可以求出各物质之间的质量比,据此列出方程式计算,可得出原混合物中碳酸钠的质量,再用总量-碳酸钠的质量=氯化钠的质量,求出氯化钠的质量;
(3)欲求恰好完全反应时溶液中溶质的质量分数,应根据质量分数公式 溶质质量溶液质量×100%,找出所须条件,进行解答.
(2)根据化学方程式可以求出各物质之间的质量比,据此列出方程式计算,可得出原混合物中碳酸钠的质量,再用总量-碳酸钠的质量=氯化钠的质量,求出氯化钠的质量;
(3)欲求恰好完全反应时溶液中溶质的质量分数,应根据质量分数公式 溶质质量溶液质量×100%,找出所须条件,进行解答.
解答:解:(1)A点开始生成物不再增加.故答案为:A
(2)解:设碳酸钠的质量为x,反应生成的氯化钠质量为y.
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 2×58.5
x 4g y
=
=
X=4.24g y=4.68g
(2)原混合物中氯化钠的质量为:14g-4.24g=9.76g 故答案为:原混合物中氯化钠的质量为:9.76g
(3)反应后氯化钠的质量分数=
×100%=14.44% 故答案为:反应后氯化钠的质量分数14.44%
(2)解:设碳酸钠的质量为x,反应生成的氯化钠质量为y.
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 2×58.5
x 4g y
| 106 |
| x |
| 100 |
| 4g |
| 2×58.5 |
| y |
| 100 |
| 4g |
X=4.24g y=4.68g
(2)原混合物中氯化钠的质量为:14g-4.24g=9.76g 故答案为:原混合物中氯化钠的质量为:9.76g
(3)反应后氯化钠的质量分数=
| (14g-4.24g)+4.68g |
| 70g+14g+20g-4g |
点评:本题主要考查学生对完全反应的认识,以及应用公式和化学方程式进行正确计算的能力,学生必须有牢固的知识,再加上认真细心的态度,方可完成.

练习册系列答案
相关题目
 (2013?泰安)小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液.他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验.
(2013?泰安)小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液.他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验.