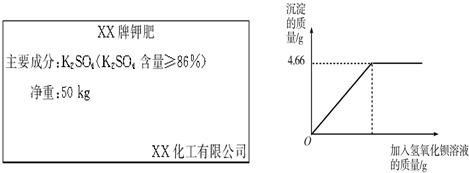
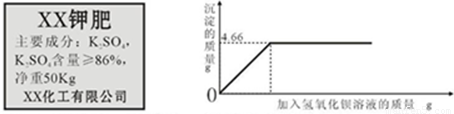
题目内容
对化肥的销售,国家有明确的质量要求.某农业科技人员对某商品销售的一种钾肥进行了检测,称取4.0g样品放入小烧杯中,加入15g水溶解后,与30g氢氧化钡溶液充分反应.产生沉淀的质量与所加氢氧化钡溶液质量的关系如图所示.

(1)K2SO4中钾元素、碳元素、氧元素的质量比为______.
(2)通过计算钾肥中硫酸钾的质量分数,判断该产品是否符合包装说明.(假设杂质不参加反应,下同)
(3)计算反应完后溶液中溶质的质量分数.(计算结果保留到整数)
解:(1)K2SO4中钾元素、碳元素、氧元素的质量比为29×2:32:16×4=39:16:32;
(2)由图象可知该反应生成的沉淀质量是4.66g,设钾肥中硫酸钾的质量是x,氢氧化钾的质量是y
K2SO4+Ba(OH)2═BaSO4↓+2KOH
174 233 112
x 4.66g y
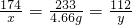
x=3.48g y=2.24g
所以硫酸钾的质量分数为: ×100%=87%,大于86%,所以该产品符合包装说明;
×100%=87%,大于86%,所以该产品符合包装说明;
(3)反应完后溶液中溶质的质量分数为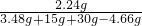 ×100%=5%
×100%=5%
故答案为:(1)39:16:32;(2)钾肥中硫酸钾的质量分数为87%,大于86%,所以该产品符合包装说明;(3)反应完后溶液中溶质的质量分数为5%.
分析:(1)依据化学式的有关计算解答即可;
(2)根据硫酸钾和氢氧化钡会生成硫酸钡沉淀,从图象中看出生成的沉淀量利用方程式计算氢氧化钾的质量,再计算该样品的质量分数与标准比较来判断;
(3)依据生成的硫酸钠质量以及反应后溶液的质量求出溶液中溶质的质量分数.
点评:在解此类题时,首先分析题中考查的问题,然后结合图象中的知识列出等量关系进行解答需要的数据.
(2)由图象可知该反应生成的沉淀质量是4.66g,设钾肥中硫酸钾的质量是x,氢氧化钾的质量是y
K2SO4+Ba(OH)2═BaSO4↓+2KOH
174 233 112
x 4.66g y
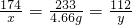
x=3.48g y=2.24g
所以硫酸钾的质量分数为:
 ×100%=87%,大于86%,所以该产品符合包装说明;
×100%=87%,大于86%,所以该产品符合包装说明;(3)反应完后溶液中溶质的质量分数为
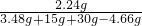 ×100%=5%
×100%=5%故答案为:(1)39:16:32;(2)钾肥中硫酸钾的质量分数为87%,大于86%,所以该产品符合包装说明;(3)反应完后溶液中溶质的质量分数为5%.
分析:(1)依据化学式的有关计算解答即可;
(2)根据硫酸钾和氢氧化钡会生成硫酸钡沉淀,从图象中看出生成的沉淀量利用方程式计算氢氧化钾的质量,再计算该样品的质量分数与标准比较来判断;
(3)依据生成的硫酸钠质量以及反应后溶液的质量求出溶液中溶质的质量分数.
点评:在解此类题时,首先分析题中考查的问题,然后结合图象中的知识列出等量关系进行解答需要的数据.

练习册系列答案
相关题目