题目内容
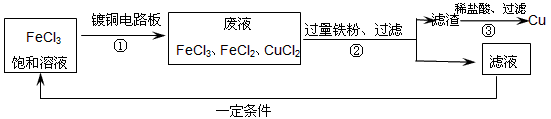
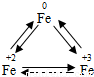
 铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示:
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示:(1)写出工业上以赤铁矿(主要成分为Fe2O3)为原料炼铁的化学方程式
| +3 |
| Fe |
| 0 |
| Fe |
(2)FeCl2易被空气中的氧气氧化成FeCl3.所以在配制FeCl2溶液时,常常向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2.请根据上述信息写出FeCl3重新转化为FeCl2的化学方程式
(3)下图表示的是一种医疗上用来治疗贫血的药品-硫酸亚铁片的说明书.

计算FeSO4?7H2O的相对分子质量
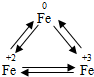
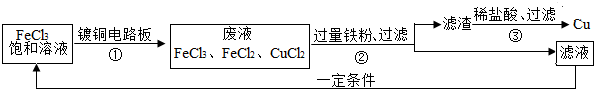
(4)FeCl3能腐蚀铜,工业上常用此原理制作印刷线路板.下图是印刷线路板的制作及废液的处理过程:
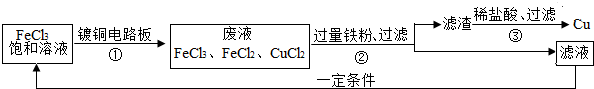
其中滤渣的成分有
分析:(1)根据工业上炼铁的原理进行分析;
(2)根据题中的叙述找出反应物、生成物书写方程式;
(3)根据相对原子质量进行分析;
根据FeCl2易被空气中的氧气氧化成FeCl3进行分析;
(4)根据加入的铁的质量和金属活动性顺序进行分析;
根据滤渣的成分进行分析;
根据流程中的各种反应物、生成物进行分析.
(2)根据题中的叙述找出反应物、生成物书写方程式;
(3)根据相对原子质量进行分析;
根据FeCl2易被空气中的氧气氧化成FeCl3进行分析;
(4)根据加入的铁的质量和金属活动性顺序进行分析;
根据滤渣的成分进行分析;
根据流程中的各种反应物、生成物进行分析.
解答:解:(1)工业炼铁是利用一氧化碳将铁从矿石中还原出来,一氧化碳和氧化铁在在高温的条件下生成铁和二氧化碳;
(2)铁和氯化铁反应生成氯化亚铁;
(3)从相对原子质量表可知,56+32+4×16+7×(2×1+16)=278;
二价的铁在空气中很容易被氧化成三价的铁,
(4)废液中加入的是过量的铁粉,铁会将铜置换出来,反应后的滤渣中有反应剩余的铁和置换出的铜,铁会与盐酸反应生成氯化亚铁和氢气,反应生成的氯化亚铁和铜可以重复使用,
故答案为:(1)3CO+Fe2O3
3CO2+2Fe
(2)Fe+2FeCl3═3FeCl2
(3)278,防止硫酸亚铁被氧化
(4)Cu、Fe,Fe+2HCl═FeCl2+H2↑,Cu、FeCl2
(2)铁和氯化铁反应生成氯化亚铁;
(3)从相对原子质量表可知,56+32+4×16+7×(2×1+16)=278;
二价的铁在空气中很容易被氧化成三价的铁,
(4)废液中加入的是过量的铁粉,铁会将铜置换出来,反应后的滤渣中有反应剩余的铁和置换出的铜,铁会与盐酸反应生成氯化亚铁和氢气,反应生成的氯化亚铁和铜可以重复使用,
故答案为:(1)3CO+Fe2O3
| ||
(2)Fe+2FeCl3═3FeCl2
(3)278,防止硫酸亚铁被氧化
(4)Cu、Fe,Fe+2HCl═FeCl2+H2↑,Cu、FeCl2
点评:在解此类题时,首先对题意进行充分的理解,然后根据题中给出的知识结合学过的知识进行分析解答.

练习册系列答案
相关题目
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料。已知不同价态的铁元素之间能相互转化,转化关系如下图1所示:
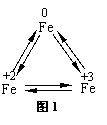 |
(1)写出工业上以赤铁矿(主要成分为Fe2O3)为原料炼铁的化学方程式 ,这个反应实现了 的转化。
(2)FeCl2易被空气中的氧气氧化成FeCl3。所以在配制FeCl2溶液时,常常向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2。请根据上述信息写出FeCl3重新转化为FeCl2的化学方程式__________ 。
(3)图2表示的是一种医疗上用来治疗贫血的药品—硫酸亚铁片的说明书。
 |
计算FeSO4·7H2O的相对分子质量_________。药片表面的糖衣可以起到________作用。
(4)FeCl3能腐蚀铜,工业上常用此原理制作印刷线路板。图3是印刷线路板的制作及废液的处理过程:

其中滤渣的成分有__________,步骤③中发生反应的化学方程式有_______________ _;该流程中可以回收利用的物质有__________________。
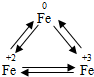 铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示:
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示: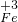 →
→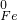 的转化.
的转化.
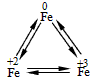
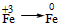 的转化。
的转化。