题目内容
室温下的某溶液100g,取50g该溶液将其蒸发掉10g水冷却至室温得晶体2.2g(晶体不含结晶水),另取该溶液50g蒸发掉15g水冷却至室温得到晶体3.4g.若两次实验结果都准确,则该物质在室温时的溶解度为
- A.22g
- B.34g
- C.24g
- D.48g

根据下图回答问题。
 |
(1)仪器a的名称是 。
(2)实验室制取二氧化碳所选用的发生装置是 (填装置序号,下同),不选择装置E收集二氧化碳的原因是______________________。
(3)实验室用高锰酸钾制取氧气反应的化学方程式是 _____________________ ,
所选用的收集装置是E或 。主要的实验步骤有:①加热 ②装药品并固定
试管 ③检查装置的气密性 ④用排水法收集氧气 ⑤停止加热 ⑥将导管从水
槽中取出。正确的操作顺序是 _____________ (用序号表示)。
(1)酒精灯(2)B 二氧化碳能溶于水且与水反应(只答一点给分)
|
32.(5分)32.(5分)某化学小组测定空气中氧气的体积分数。
 (1)根据右图回答问题。
(1)根据右图回答问题。
①红磷燃烧的化学方程式为__________________________________。
②若将红磷改为木炭,反应结束后降至室温,打开止水夹,烧杯
中的水不倒吸入集气瓶的原因是______________________________
 _______________________________________________。
_______________________________________________。
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。
反应原理为:2Na2S4+O2+2H2O 8S↓+4NaOH(氢氧化钠)。
小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水
的氢氧化钠。
【实验过程】
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。
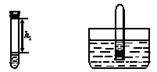
图1 图2
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到__________,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2∶h1= 。
③按照①和② 再重复实验2次。3次实验数据如下表所示。
再重复实验2次。3次实验数据如下表所示。
| 第1次 | 第2次 | 第3次 | |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
根据第3次实验数据,计算空气中氧气的体积分数为 %(结果精确到 0.1%)。
(1)①4P + 5O 2 2P2O5
2P2O5
② 因为木炭燃烧生成二氧化碳气体,集气瓶内气体体积不变,瓶内气体压强没有明显变
因为木炭燃烧生成二氧化碳气体,集气瓶内气体体积不变,瓶内气体压强没有明显变
化,所以,当打开止水夹时水不会吸入到集气瓶中。
(2)②试管内液面上升至液面高度不再改变 79∶100(或4∶5)  ③ 20.7
③ 20.7
33.(8分)某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为______________________________________。
(2)表格中的“测量数据”的指的是:相同时间内_________________________________。
(3)本实验中,测量O2体积的装置是________(填编号)。
 |
【实验结论】
在相同条件下______________________________________________。
【交流评价】
(1)甲同学提出在上述实验中测量______________同样能得出相同的结论。
 (2)乙同学提出用右图装置进行实验,通过比较_____________
(2)乙同学提出用右图装置进行实验,通过比较_____________
___________________也能达到实验目的。
【实验反思】
除了上述因素会影响过氧化氢分解速度外, ___________(写
一种)也会影响过氧化氢分解速度,你的实验方案是______________________________________________________________________。
 (2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.