题目内容
C是大理石的主要成分,为白色固体,A为含三种元素的钠盐,与C相比含有两种元素相同.请填空:
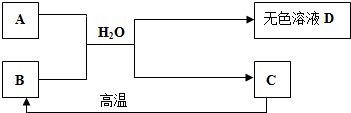
(1)写出C在高温下生成B的化学方程式______.
(2)将A、B放入水中相互间发生了化学反应,请写出属于化合反应类型的化学方程式______.
(3)溶液D中一定含有的溶质是______(填写化学式).
(4)溶液D还可能含有溶质是______.请设计化学实验证明你对可能含有溶质的推测.
| 实验操作 | 实验现象 | 实验结论 |
| ______ | ______ | 我的推测正确 |
解:(1)C是大理石的主要成分,为白色固体说明C是碳酸钙,碳酸钙分解的反应物是碳酸钙,生成物是氧化钙和二氧化碳,二氧化碳后面标上上升符号,反应条件是高温;
(2)A为含三种元素的钠盐,与C相比含有两种元素相同元素,C是碳酸钙,因为A是钠盐,不可能含有钙,所以剩余两种元素:碳和氧属于共同元素,所以A为碳酸钠;碳酸钙高温生成氧化钙和二氧化碳,如果B是二氧化碳,二氧化碳与碳酸钠不反应,二氧化碳与水反应生成的碳酸也不能与碳酸钠反应,所以B是氧化钙,氧化钙与水反应生成氢氧化钙,属于化合反应;
(3)氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以溶液D中一定含有的溶质是氢氧化钠;
(4)如果氢氧化钙与碳酸钠恰好反应生成碳酸钙沉淀和氢氧化钠,溶液D中溶质只有氢氧化钠,如果反应物过量时,溶质中会混有反应物,如果氢氧化钙过量,则混有氢氧化钙,如果碳酸钠过量则混有碳酸钠,二者不能共同过量,都剩余时会继续反应.检验是否含有氢氧化钙,向溶液中通入二氧化碳,如果变浑浊,说明含有氢氧化钙,因为二氧化碳能与氢氧化钙反应生成碳酸钙白色沉淀和水;检验是否含有碳酸钠,主要验证是否含有碳酸根离子,加入稀盐酸,如果有气体生成说明含有碳酸钠,因为碳酸钠与盐酸反应生成氯化钠、水、二氧化碳;或者加入可溶性的钙盐或钡盐,能产生白色沉淀,说明含有碳酸钠.
故答案为:(1)CaCO3 CaO+CO2↑;(2)H2O+CaO═Ca(OH)2;(3)NaOH;(4)Ca(OH)2(或Na2CO3)
CaO+CO2↑;(2)H2O+CaO═Ca(OH)2;(3)NaOH;(4)Ca(OH)2(或Na2CO3)
分析:(1)由C是大理石的主要成分,为白色固体说明C是碳酸钙,再根据碳酸钙高温分解来回答本题;(2)碳酸钙高温生成氧化钙和二氧化碳,A为含三种元素的钠盐,与C相比含有两种元素相同元素,所以A为碳酸钠,如果B是二氧化碳,二氧化碳与碳酸钠不反应,二氧化碳与水反应生成的碳酸也不能与碳酸钠反应,所以B是氧化钙,再根据相互之间的反应考虑属于化合反应的反应;(3)根据碳酸钠、氧化钙、水之间发生的反应进行分析;(4)根据反应物如果过量进行讨论,验证氢氧化钙可以用二氧化碳,验证碳酸钠可以用酸或钙盐等.
点评:解答本题关键是要知道判断反应后溶液中溶质时,有两种情况:如果恰好完全反应,则根据生成物来判断即可,如果反应物过量时,哪一种物质过量生成物中的溶质就还含有这种溶质,反应物中的物质不能都过量.
(2)A为含三种元素的钠盐,与C相比含有两种元素相同元素,C是碳酸钙,因为A是钠盐,不可能含有钙,所以剩余两种元素:碳和氧属于共同元素,所以A为碳酸钠;碳酸钙高温生成氧化钙和二氧化碳,如果B是二氧化碳,二氧化碳与碳酸钠不反应,二氧化碳与水反应生成的碳酸也不能与碳酸钠反应,所以B是氧化钙,氧化钙与水反应生成氢氧化钙,属于化合反应;
(3)氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以溶液D中一定含有的溶质是氢氧化钠;
(4)如果氢氧化钙与碳酸钠恰好反应生成碳酸钙沉淀和氢氧化钠,溶液D中溶质只有氢氧化钠,如果反应物过量时,溶质中会混有反应物,如果氢氧化钙过量,则混有氢氧化钙,如果碳酸钠过量则混有碳酸钠,二者不能共同过量,都剩余时会继续反应.检验是否含有氢氧化钙,向溶液中通入二氧化碳,如果变浑浊,说明含有氢氧化钙,因为二氧化碳能与氢氧化钙反应生成碳酸钙白色沉淀和水;检验是否含有碳酸钠,主要验证是否含有碳酸根离子,加入稀盐酸,如果有气体生成说明含有碳酸钠,因为碳酸钠与盐酸反应生成氯化钠、水、二氧化碳;或者加入可溶性的钙盐或钡盐,能产生白色沉淀,说明含有碳酸钠.
故答案为:(1)CaCO3
 CaO+CO2↑;(2)H2O+CaO═Ca(OH)2;(3)NaOH;(4)Ca(OH)2(或Na2CO3)
CaO+CO2↑;(2)H2O+CaO═Ca(OH)2;(3)NaOH;(4)Ca(OH)2(或Na2CO3)| 实验操作 | 实验现象 | 实验结论 |
| 向溶液D中通入二氧化碳(或滴加稀盐酸) | 变浑浊(有气泡产生) | 我的推测正确 |
分析:(1)由C是大理石的主要成分,为白色固体说明C是碳酸钙,再根据碳酸钙高温分解来回答本题;(2)碳酸钙高温生成氧化钙和二氧化碳,A为含三种元素的钠盐,与C相比含有两种元素相同元素,所以A为碳酸钠,如果B是二氧化碳,二氧化碳与碳酸钠不反应,二氧化碳与水反应生成的碳酸也不能与碳酸钠反应,所以B是氧化钙,再根据相互之间的反应考虑属于化合反应的反应;(3)根据碳酸钠、氧化钙、水之间发生的反应进行分析;(4)根据反应物如果过量进行讨论,验证氢氧化钙可以用二氧化碳,验证碳酸钠可以用酸或钙盐等.
点评:解答本题关键是要知道判断反应后溶液中溶质时,有两种情况:如果恰好完全反应,则根据生成物来判断即可,如果反应物过量时,哪一种物质过量生成物中的溶质就还含有这种溶质,反应物中的物质不能都过量.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目