题目内容
不纯的镁粉3克,放入盛有50克稀硫酸的烧杯中,恰好完全反应,测知烧杯中物质质量减少了0.2克.(杂质不溶于稀硫酸)试求:(1)镁粉中含杂质的质量分数.
(2)稀硫酸溶液的质量分数.
【答案】分析:镁与硫酸反应生成硫酸镁和氢气,由于气体氢气放出而使反应后烧杯内物质质量减少,即减少的质量为氢气的质量;根据反应的化学方程式,由氢气的质量可计算出参加反应金属镁的质量及硫酸的质量;然后利用镁的质量与不纯镁粉质量比、硫酸与稀硫酸的质量比求出所要计算的质量分数.
解答:解:设镁粉中镁的质量为x,稀硫酸中含硫酸的质量为y
Mg+H2SO4═MgSO4+H2↑
24 98 2
x y 0.2g
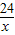 =
=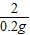 x=2.4g
x=2.4g
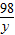 =
=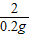 y=9.8g
y=9.8g
镁粉中含杂质的质量分数=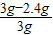 ×100%=20%
×100%=20%
稀硫酸溶液的质量分数= ×100%=19.6%
×100%=19.6%
答:(1)镁粉中含杂质的质量分数为20%;(2)稀硫酸溶液的质量分数为19.6%.
点评:化学方程式可表示反应中各物质质量关系,利用反应中各物质的质量关系,由其中任意一物质的质量都可计算出反应中其它物质的质量.
解答:解:设镁粉中镁的质量为x,稀硫酸中含硫酸的质量为y
Mg+H2SO4═MgSO4+H2↑
24 98 2
x y 0.2g
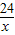 =
=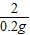 x=2.4g
x=2.4g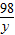 =
=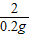 y=9.8g
y=9.8g镁粉中含杂质的质量分数=
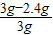 ×100%=20%
×100%=20%稀硫酸溶液的质量分数=
 ×100%=19.6%
×100%=19.6%答:(1)镁粉中含杂质的质量分数为20%;(2)稀硫酸溶液的质量分数为19.6%.
点评:化学方程式可表示反应中各物质质量关系,利用反应中各物质的质量关系,由其中任意一物质的质量都可计算出反应中其它物质的质量.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目