题目内容
钢铁工业是国家工业的基础.
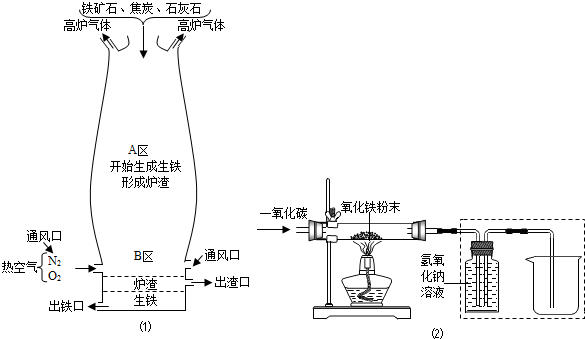
(1)如图(1)是教材中炼铁高炉及炉内化学变化过程示意图,B区的反应主要是生成一氧化碳,若采用的铁矿石主要成分为氧化铁,请写出A区所发生主要反应的化学方程式:______;
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,并对固体产物成分等进行探究.
【设计实验】
用一氧化碳还原纯净的氧化铁粉末,实验装置如图(2)
【进行实验】
该小组按上述实验设计,在一定温度下进行了实验,实验过程中除观察到红色固体变为黑色以外,还能观察到______;
【分析与讨论】
本实验结束后,玻璃管内固体粉末由红色全部变为黑色,小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出先查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能是铁,也可能生成铁的氧化物.
③铁的氧化物都能与稀硫酸反应生成盐和水
④有关铁及其氧化物的性质如下:
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有______和______(填铁的氧化物);
②进行猜想:黑色固体粉末可能
a.全部为铁 b.______ c.______;
【验证猜想】
(1)取样品于试管中,向其中加入适量的稀硫酸,若观察到______,只有猜想______成立;
(2)取样品于试管中,向其中加入适量硫酸铜溶液,若观察到______,只有猜想______成立;
【反思与评价】实验装置图(2)中采用虚线框内的装置,其作用有______(填字母).
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
解:(1)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO 2Fe+3CO2 .
2Fe+3CO2 .
故填:Fe2O3+3CO 2Fe+3CO2 .
2Fe+3CO2 .
(2)【进行实验】
一氧化碳不溶于水,不能和氢氧化钠溶液反应,未反应的一氧化碳进入氢氧化钠溶液后,能使氢氧化钠溶液进入烧杯中.
故填:溶液进入烧杯中.
【实验与猜想】
①黑色固体粉末全部能被吸引,说明黑色粉末中含有铁,或含有四氧化三铁,或含有铁和四氧化三铁,不可能含有氧化亚铁和氧化铁.
故填:氧化亚铁;氧化铁.
②黑色固体粉末可能是:全部是铁,或全部是四氧化三铁,或铁和四氧化三铁.
故填:全部是四氧化三铁;铁和四氧化三铁.
【验证猜想】
(1)取样品于试管中,向其中加入适量的稀硫酸,若观察到有气泡产生,溶液为浅绿色,只有猜想a成立;
故填:有气泡产生,溶液为浅绿色;a.
(2)取样品于试管中,向其中加入适量硫酸铜溶液,若观察到硫酸铜溶液不变色,只有猜想b成立;
故填:硫酸铜溶液不变色;b.
【反思与评价】
实验装置图(2)中采用虚线框内的装置,其作用是吸收二氧化碳后得到纯净的一氧化碳.为AB.
故填:AB.
分析:(1)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳;
(2)【进行实验】
一氧化碳不溶于水,不能和氢氧化钠溶液反应;
【实验与猜想】
黑色固体粉末全部能被吸引,说明黑色粉末中含有铁,或含有四氧化三铁,或含有铁和四氧化三铁;
【验证猜想】
(1)铁能和稀硫酸反应生成硫酸亚铁和氢气;
(2)铁能和硫酸铜溶液反应生成硫酸亚铁和铜;
【反思与评价】
氢氧化钠溶液能够吸收二氧化碳气体.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.
 2Fe+3CO2 .
2Fe+3CO2 .故填:Fe2O3+3CO
 2Fe+3CO2 .
2Fe+3CO2 .(2)【进行实验】
一氧化碳不溶于水,不能和氢氧化钠溶液反应,未反应的一氧化碳进入氢氧化钠溶液后,能使氢氧化钠溶液进入烧杯中.
故填:溶液进入烧杯中.
【实验与猜想】
①黑色固体粉末全部能被吸引,说明黑色粉末中含有铁,或含有四氧化三铁,或含有铁和四氧化三铁,不可能含有氧化亚铁和氧化铁.
故填:氧化亚铁;氧化铁.
②黑色固体粉末可能是:全部是铁,或全部是四氧化三铁,或铁和四氧化三铁.
故填:全部是四氧化三铁;铁和四氧化三铁.
【验证猜想】
(1)取样品于试管中,向其中加入适量的稀硫酸,若观察到有气泡产生,溶液为浅绿色,只有猜想a成立;
故填:有气泡产生,溶液为浅绿色;a.
(2)取样品于试管中,向其中加入适量硫酸铜溶液,若观察到硫酸铜溶液不变色,只有猜想b成立;
故填:硫酸铜溶液不变色;b.
【反思与评价】
实验装置图(2)中采用虚线框内的装置,其作用是吸收二氧化碳后得到纯净的一氧化碳.为AB.
故填:AB.
分析:(1)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳;
(2)【进行实验】
一氧化碳不溶于水,不能和氢氧化钠溶液反应;
【实验与猜想】
黑色固体粉末全部能被吸引,说明黑色粉末中含有铁,或含有四氧化三铁,或含有铁和四氧化三铁;
【验证猜想】
(1)铁能和稀硫酸反应生成硫酸亚铁和氢气;
(2)铁能和硫酸铜溶液反应生成硫酸亚铁和铜;
【反思与评价】
氢氧化钠溶液能够吸收二氧化碳气体.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

练习册系列答案
相关题目
钢铁工业是国家工业的基础.2007年我国粗钢产量接近5亿吨,居世界前列.湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃.某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%).
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
①计算硫酸溶液中溶质的质量 g
②求在实验3中反应后所得的溶液中溶质的质量分数?
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
序数 质量 |
实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
②求在实验3中反应后所得的溶液中溶质的质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?

 序数
序数