题目内容
某校化学研究性学习课题组的同学为了测定某氢氧化钙样品中Ca(OH)2的质量分数(含有的杂质为CaCO3),共做了三次实验,使一定量的该样品分别与溶质质量分数相同的稀盐酸反应,所得相关实验数据记录如下表:
| 第1次 | 第2次 | 第3次 | |
| 所取试样质量 | 17.4g | 17.4g | 17.4g |
| 所取稀盐酸质量 | 80g | 100g | 120g |
| 生成CO2质量 | 2.64g | 4.4g | 4.4g |
(2)原样品中Ca(OH)2的质量分数为________(精确到0.1%).
(3)经测定第2次实验反应完全后,所得溶液中的溶质只有一种,通过计算求所得溶液中的溶质质量分数为多少?(精确到0.1%)________.
解:(1)根据实验数据分析可知,17.4g样品中的碳酸钙完全反应生成4.4g的二氧化碳,而第一次实验中只生成2.64g二氧化碳,说明第一次实验中样品中的碳酸钙有剩余.故答案为:1
(2)设样品中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
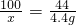
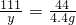
x=10g y=11.1g
 %=42.5%
%=42.5%
答:样品中氢氧化钙的质量分数为42.5%.
(3)设氢氧化钙与盐酸反应生成的氯化钙的质量为z
Ca(OH)2+2HCl═CaCl2+2H2O
74 111
7.4g z

z=11.1g
所得溶液中溶质的质量分数= %=19.6%
%=19.6%
答:所得溶液中溶质的质量分数为19.6%.
分析:(1)根据实验数据分析可知17.4g样品中的碳酸钙完全反应生成二氧化碳的质量,进而可确定哪组实验中的碳酸钙未反应完.
(2)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量,进而求出氢氧化钙的质量,最后根据 %可求出样品中氢氧化钙的质量分数.
%可求出样品中氢氧化钙的质量分数.
(3)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙与盐酸反应生成的氯化钙的质量,利用氢氧化钙与盐酸反应的化学方程式,根据氢氧化钙的质量可求出氢氧化钙与盐酸反应生成的氯化钙的质量,将两部分氯化钙的质量加起来则为所得溶液中溶质的质量,用所加入的所有物质的质量总和-生成二氧化碳的质量即为所得溶液的质量.最后根据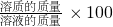 %即可求出所得溶液中溶质的质量分数.
%即可求出所得溶液中溶质的质量分数.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.
(2)设样品中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
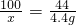
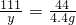
x=10g y=11.1g
 %=42.5%
%=42.5%答:样品中氢氧化钙的质量分数为42.5%.
(3)设氢氧化钙与盐酸反应生成的氯化钙的质量为z
Ca(OH)2+2HCl═CaCl2+2H2O
74 111
7.4g z

z=11.1g
所得溶液中溶质的质量分数=
 %=19.6%
%=19.6%答:所得溶液中溶质的质量分数为19.6%.
分析:(1)根据实验数据分析可知17.4g样品中的碳酸钙完全反应生成二氧化碳的质量,进而可确定哪组实验中的碳酸钙未反应完.
(2)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量,进而求出氢氧化钙的质量,最后根据
 %可求出样品中氢氧化钙的质量分数.
%可求出样品中氢氧化钙的质量分数.(3)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙与盐酸反应生成的氯化钙的质量,利用氢氧化钙与盐酸反应的化学方程式,根据氢氧化钙的质量可求出氢氧化钙与盐酸反应生成的氯化钙的质量,将两部分氯化钙的质量加起来则为所得溶液中溶质的质量,用所加入的所有物质的质量总和-生成二氧化碳的质量即为所得溶液的质量.最后根据
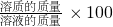 %即可求出所得溶液中溶质的质量分数.
%即可求出所得溶液中溶质的质量分数.点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.

练习册系列答案
相关题目
 某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
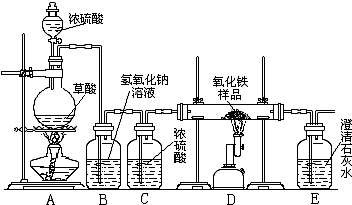
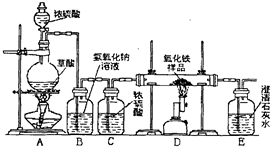 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应: CO↑+CO2↑+H2O
CO↑+CO2↑+H2O