题目内容
【题目】一同学取来某品牌的钾肥,主要成分硫酸钾,还含少量的氯化钾共200克,投入到908克的氯化钡溶液中恰好完全反应.经过滤后得到硫酸钡沉淀233克和氯化钾的不饱和溶液.请帮他计算:(注明:K2SO4+BaCl2=BaSO4↓+2KCl)
(1)硫酸钾中钾、硫、氧的原子个数比是 , 氯化钾的相对分子质量是 .
(2)200克该品牌的钾肥中硫酸钾的质量是多少?
(3)反应后所得氯化钾不饱和溶液中溶质的质量分数是多少?
【答案】
(1)2:1:4;74.
(2)解:设200克该品牌的钾肥中硫酸钾的质量是x,生成氯化钾的质量为y.
K2SO4+BaCl2= | 2KCl+ | BaSO4↓ |
174 | 149 | 233 |
x | y | 233g |
![]()
x=174g
![]()
y=149g
答:200克该品牌的钾肥中硫酸钾的质量是174g
(3)解:反应后所得氯化钾不饱和溶液中溶质的质量分数是= ![]() =20.0%
=20.0%
答:反应后所得氯化钾不饱和溶液中溶质的质量分数是20.0%
【解析】解:(1)硫酸钾的化学式为K2SO4可知硫酸钾中钾、硫、氧的原子个数比=2:1:4;氯化钾的化学式为KCl可知氯化钾的相对分子质量=39+35.5=74.5;故填:2:1:4;74.5;
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

【题目】用整理和分类的方法学习和研究化学物质往往达到事半功倍的效果,请你填写下列空格: 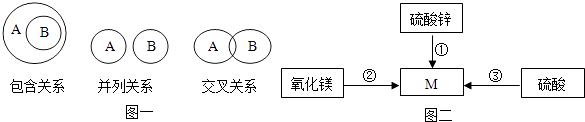
(1)逻辑关系:物质类属间存在着如图一关系,其中酸和盐属于关系.
(2)转化关系:图二表示几种化合物能通过一步反应转化为含镁化合物M,那么物质M应属于(选填“单质”、“氧化物”、“酸”、“碱”或“盐”);
(3)影射关系:根据物质的组成、结构、性质及用途之间的内在关系,填写下表中的空白(○表示氧原子,●表示碳原子).
物质的化学式 | 物质的分子结构 | 物质的性质 | 物质的用途 |
① |
| ② | 火箭推进剂 |
CO2 |
| 密度比空气大,一般不燃烧,也不支持燃烧 | ③ |