题目内容
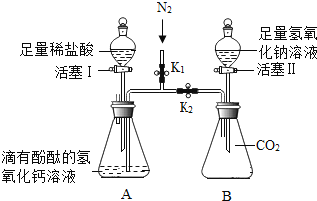
【题目】某同学将一定质量的碳酸氢钠和稀硫酸混合,反应完全后(假设反应产生的气体全部逸出),对反应后溶液中溶质的成分进行如下探究:
【实验用品】pH试纸、Zn片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
【假设猜想】猜想一:硫酸钠 猜想二:硫酸钠、碳酸氢钠 猜想三:硫酸钠、硫酸
【实验探究】同学们取反应后的溶液用不同方案进行如下实验,请根据现象或结论填空。
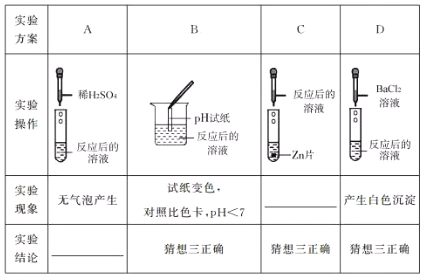
【得出结论】猜想三正确。
【评价反思】老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在两处明显错误。分别是:
① ; ② 。
【总结提高】依据所给实验用品,你还有什么不同类方案确认猜想三是正确的。请你写出你的实验方案 。
【答案】实验现象:有气泡产生,锌片不断溶解;实验结论:猜想二不正确【评价反思】①方案B中pH试纸浸入溶液中②方案D中硫酸钠与氯化钡反应也会产生白色沉淀,不能证明一定有硫酸存在【总结提高】取少量氧化铜粉末于试管中,加入足量反应后的溶液,若氧化铜溶解,溶液变蓝,则猜想三正确
【解析】
试题分析:根据实验结论可知,方案C的实验现象为锌片不断溶解,有气泡产生;方案A得到的结论为猜想二不正确,猜想二中含有碳酸氢钠,加入盐酸有气泡产生;【评价反思】老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在两处明显错误。分别是:①方案B中pH试纸浸入溶液中②方案D中硫酸钠与氯化钡反应也会产生白色沉淀,不能证明一定有硫酸存在;【总结提高】依据所给实验用品,还有不同类方案确认猜想三是正确的。具体方案为】取少量氧化铜粉末于试管中,加入足量反应后的溶液,若氧化铜溶解,溶液变蓝,则猜想三正确。

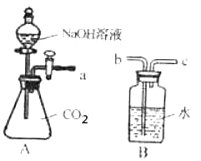
【题目】某兴趣小组同学欲探究NaOH溶液与CO2气体的反应,设计如图所示实验装置:
(1)若导管a与b连接,将分液漏斗中的NaOH溶液注入锥形瓶,关闭分液漏斗上的活塞,振荡,然后打开导管上的活塞,观察到的实验现象是________,CO2与NaOH反应的化学方程式是________;
(2)探究反应后锥形瓶内溶液中溶质的成分:
已知Na2CO3+H2O+CO2═2NaHCO3 NaHCO3+NaOH═Na2CO3+H2O
【提出猜想】
Ⅰ.NaOH和Na2CO3;
Ⅱ.________;
Ⅲ.NaHCO3;
Ⅳ.Na2CO3和NaHCO3.
【查阅资料】①Ca(OH)2与Na2CO3、NaHCO3均能反应且有白色沉淀生成;
②CaCl2与Na2CO3能反应且有白色沉淀生成,与NaHCO3不反应;
③NaHCO3溶液显碱性,可与酸反应生成CO2气体。
【设计实验】限选试剂:Ca(OH)2溶液、CaCl2溶液、稀盐酸、酚酞试液.
实验操作 | 实验现象 | 实验结论 |
1.取少量反应后溶液于试管中,加入足量的________振荡 | 产生白色沉淀 _________ | 猜想Ⅲ不成立 |
2.将操作Ⅰ所得混合物过滤,向滤液中加入足量的_________,振荡 | _________ | 猜想Ⅳ成立 |
【拓展应用】联想到空气中有CO2,所以实验室中的氢氧化钠溶液应_________保存。