��Ŀ����
����Ŀ����������װ��ͼ���ش��й����⣺ 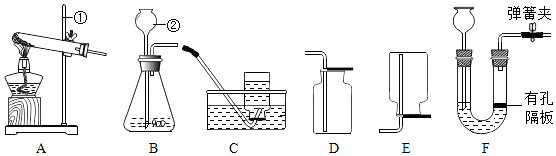
��1��д���б�ŵ��������ƣ��� �� �� ��
��2��ʵ����Ҫ�Ƶø����O2 �� ѡ���ʵ����ȡװ���� �� ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ������ȡCO2ѡ��F��ȡ���ŵ�Ϊ �� ���ø�װ��Ҳ���Ʊ����壮
��4��������100g��������Ϊ7.3%��ϡ���ᣬ����ȡŨ����ʱ���Ӷ������������Ƶ�ϡ������������������ƫ����ƫС��������ȷ���Ƶ�����ϡ����ȫ������ʢ��20g��ʯ��ʯ��Ʒ���ձ��У�ǡ������ʯ��ʯ��Ʒ�е�̼�����ȫ��Ӧ�����ʲ���ϡ���ᷴӦ�������ʯ��ʯ��Ʒ��̼��Ƶ����������Ƕ��٣���д��������̣�
���𰸡�
��1������̨������©��
��2��AD��2KClO3 ![]() 2KCl+3O2��
2KCl+3O2��
��3�����Ʒ�Ӧ�ķ�����ֹͣ��H2
��4��ƫС���⣺���ʯ��ʯ��Ʒ��̼��Ƶ�����Ϊx
CaCO3+ | 2HCl�TCaCl2+H2O+CO2�� |
100 | 73 |
x | 7.3g |
![]() =
= ![]()
x=10g
��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ ![]() ��100%=50%
��100%=50%
�𣺸�ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ50%
���������⣺��1�����dz��ù̶�װ�ã�Ϊ����̨�����dz����ڷ�Ӧ�з�������Һ��ҩƷ�ij���©������2��ʵ����Ҫ�Ƶø����O2 �� �ڸ�����ѡ��������ҩƷ������û�и�������װ�ã��������ѡ�ù�������ȡ�������Ҳ�����ˮ���ռ�����Aͼû�����ţ�����Ӧ����������ڶ������̵Ĵ��¼��������Ȼ��غ�������ѡ����ȡװ���� AD����Ӧ�Ļ�ѧ����ʽΪ 2KClO3 ![]() 2KCl+3O2������3��ʵ������ȡCO2ѡ��F��ȡ���ŵ�Ϊ ���Ʒ�Ӧ�ķ�����ֹͣ������װ��F�ʺϿ�״�����Һ�巴Ӧ�����Ի��������� H2 ���壮��4��������100g��������Ϊ7.3%��ϡ���ᣬ����ȡŨ����ʱ���Ӷ�������������ȡ��Ũ����ʵ��ƫС������HClƫ�٣��������������Ƶ�ϡ���������������ƫС�� ����HCl������Ϊ100g��7.3%=7.3g��
2KCl+3O2������3��ʵ������ȡCO2ѡ��F��ȡ���ŵ�Ϊ ���Ʒ�Ӧ�ķ�����ֹͣ������װ��F�ʺϿ�״�����Һ�巴Ӧ�����Ի��������� H2 ���壮��4��������100g��������Ϊ7.3%��ϡ���ᣬ����ȡŨ����ʱ���Ӷ�������������ȡ��Ũ����ʵ��ƫС������HClƫ�٣��������������Ƶ�ϡ���������������ƫС�� ����HCl������Ϊ100g��7.3%=7.3g��
���ʯ��ʯ��Ʒ��̼��Ƶ�����Ϊx
CaCO3+ | 2HCl�TCaCl2+H2O+CO2�� |
100 | 73 |
x | 7.3g |
![]() =
= ![]()
x=10g
��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ ![]() ��100%=50%
��100%=50%
�𣺸�ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ50%
���Դ��ǣ���1������̨������©������2��AD�� 2KClO3 ![]() 2KCl+3O2������3�����Ʒ�Ӧ�ķ�����ֹͣ�� H2����4��ƫС��50%��
2KCl+3O2������3�����Ʒ�Ӧ�ķ�����ֹͣ�� H2����4��ƫС��50%��
�����㾫����������Ҫ��������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ����ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮