题目内容
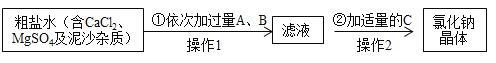
【题目】某同学要提纯含有CaCl2、MgSO4及泥沙等杂质的粗盐,将粗盐溶于适量水中,再按以下流程进行处理:
(1)写出加入试剂A时反应的化学方程式____。
(2)若未进行操作1而直接加入试剂C,对提纯结果有影响,为什么?____
(3)操作1后所得滤液中除了氯化钠还含有哪些溶质,请设计实验验证。_____(写出简单操作、现象和结论)
【答案】Ba(OH)2+MgSO4= BaSO4↓+2Mg(OH)2↓ C为稀盐酸,沉淀中的碳酸钙、碳酸钡会与稀盐酸反应生成氯化钙、氯化钡,导致氯化钠不纯 取少量滤液,加入过量BaCl2溶液,如果有白色固体生成,说明有Na2CO3;再取上层清液,加入酚酞试剂,如果溶液变红,说明有NaOH
【解析】
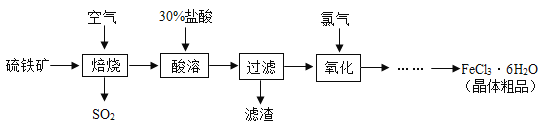
氢氧化钡与硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀,加入过量的氢氧化钡溶液可以除去硫酸镁;氯化钙与碳酸钠反应生成氯化钠和碳酸钙,加入过量的碳酸钠溶液可除去氯化钙,碳酸钠与氢氧化钡反应生成碳酸钡和氢氧化钠,加入碳酸钠溶液要放在加入的氢氧化钡溶液之后,这样碳酸钠会除去过量的氢氧化钡溶液。所以试剂A是氢氧化钡,试剂B是碳酸钠;操作Ⅰ是过滤,滤液中成分是氯化钠、碳酸钠,氢氧化钠,滤渣的成分是氢氧化镁、硫酸钡和碳酸钙、碳酸钡;氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,在滤液加入适量盐酸,通过蒸发可得到氯化钠晶体。
根据以上分析可知:
(1)加入试剂A时,反应的化学方程式为:Ba(OH)2+MgSO4= BaSO4↓+2Mg(OH)2↓;
(2)若未进行操作1而直接加入试剂C,C为稀盐酸,沉淀中的碳酸钙、碳酸钡会与稀盐酸反应生成氯化钙、氯化钡,导致氯化钠不纯;
(3)操作1后所得滤液中除了氯化钠还含有碳酸钠、氢氧化钠。碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,氢氧化钠呈碱性,能使酚酞变红色,实验验证时,先用氯化钡检验碳酸钠并完全除去碳酸钠,再用酚酞溶液检验氢氧化钠。其方法是取少量滤液,加入过量BaCl2溶液,如果有白色固体生成,说明有Na2CO3;再取上层清液,加入酚酞试剂,如果溶液变红,说明有NaOH。

 科学实验活动册系列答案
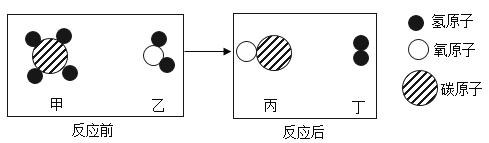
科学实验活动册系列答案【题目】某化学活动小组同学发现,不同物质在发生变化时,即使实验现象相同,其变化的实质也可能存在着本质的区别。
同学们利用如图所示的装置进行了以下两个实验。
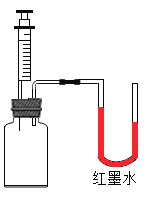
实验Ⅰ:在集气瓶底部放入一定量的硝酸铵固体,再将注射器中的水注入瓶中,振荡。
实验Ⅱ:向充满二氧化碳的集气瓶中注入一定量的氢氧化钠溶液,振荡。
(现象分析)上述两个实验过程中,U形管中液面均出现_____(填“左高右低”
或“左低右高”)现象,其中实验Ⅰ没有发生化学变化,实验Ⅱ发生了化学变化,其反应的化学方程式为_____。
(归纳总结)相同的实验现象既可以由物理变化引起,也可以由化学变化引起。
(拓展延伸)在探究白色固体的组成时,也需考虑相同现象是否存在着本质区别。
有一包白色固体,可能含有氧化钙、氢氧化钙、碳酸钙中的一种或几种。为了探究白色固体的成分,同学们做了以下实验。
步骤1:甲同学取一定量的白色固体于试管中,加入一定量的水后振荡,触摸试管外壁,没有感觉到放热现象,说明白色固体中没有_____。
试管底部有白色不溶物,甲同学认为白色固体中一定含有碳酸钙,乙同学认为上述现象不足以证明碳酸钙的存在,其理由是_____。
步骤2:为进一步得出准确的结论,他们进行了下面所示实验。
实验操作 | 实验现象 | 实验现象 |
(1)将步骤1试管中物质过滤,向滤液中滴加_____。 | 溶液由无色变成红色 | 白色固体中含有_____ |
(2)向滤出的固体中加入足量的_____。 | 有气泡产生 |
【题目】学习了碳酸钠的性质后,小莹和小雨各取三支试管做了如下实验。
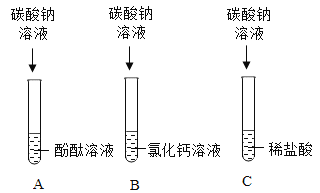
(1)试管A中酚酞溶液变为红色,说明碳酸钠溶液显_____性。
(2)试管B中的实验现象为_____。
(3)试管C中发生反应的化学方程式为_____。
实验结束后,小莹和小雨将各自三支试管中的物质分别倒入①号、②号烧杯中,静置一段时间后观察到如下实验现象,请
编号 | 实验现象 | 实验分析 |
①号烧杯 | 溶液呈红色,且有白色沉淀 | 溶液中的溶质一定有_____(填除指示剂外的全部溶质,下同) |
②号烧杯 | 溶液呈无色,没有白色沉淀 | 溶液中的溶质一定有_____,可能有HCl |
为了确定②号烧杯中可能含有的溶质是否存在,小雨同学继续进行探究。
(实验验证)
取②号烧杯中的溶液于试管中,加入锌粒后,观察到_____,说明溶质中含有HCl。
(讨论交流)
下列试剂中可以代替锌粒达到探究目的的是_____(填字母序号)。
A Fe2 O3 B CO2 C Cu
(实验反思)
两位同学讨论后一致认为,两烧杯中出现不同现象的原因是反应物的用量不同。