��Ŀ����
����Ŀ����һ������̼���ƺ� ̼�����ƵĻ���Ϊ�˲ⶨ�京����С��ȡ19g��Ʒ�����ձ��У�����100gˮ����ܽ������ϡ���Ტ���Ͻ��裬��B��ʱǡ����ȫ��Ӧ������ձ�����Һ�����������ϡ���������Ĺ�ϵ������ͼ��ʾ����Ӧ���ɵ�����ȫ���ݳ�������֪̼������ϡ���ᷴӦ���������У� ��һ����Ӧ��Na2CO3+HCl�TNaCl+NaHCO3
�ڶ�����Ӧ��NaHCO3+HCl�TNaCl+H2O+CO2��
�ش��������⣺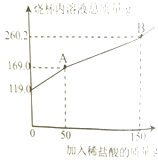
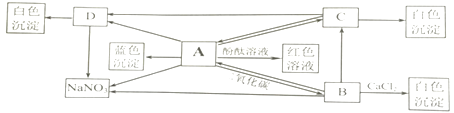
��1��A����Һ������Ϊ���ѧʽ��
��2��ͼ��AB�α�ʾ������Ӧ�����������غ㶨�ɣ���Ӧ�����ɵĶ�����̼������g��
��3���������ϡ�������������������Ƕ��٣���д��������̣�����ȷ��0.1%��
��4����Ʒ��̼�����Ƶ�������g��
���𰸡�
��1��NaHCO3��NaCl
��2������8.8
��3���⣺��AB��ϡ�������Ȼ��������Ϊx��
NaHCO3+ | HCl | =NaCl+H2O+ | CO2�� |
36.5 | 44 | ||
x | 8.8g |
�� ![]() �����x=7.3g��
�����x=7.3g��
�������ϡ������������������Ϊ�� ![]() ��100%=7.3%��
��100%=7.3%��
���������ϡ������������������Ϊ7.3%��
��4��8.4
���������⣺��1����ΪA��Ϊ��һ����ӦNa2CO3+HCl�TNaCl+NaHCO3 �� ����Ʋ�A����Һ������ΪNaHCO3��NaCl�� ����2��ͼ��AB�����������ˣ���ʾ�ڶ�������Ӧ����Ӧ�����ɵ�CO2����Ϊ��19g+100g+150g��260.2g=8.8g���������8.8��
����4����̼���Ƶ�����Ϊy��
Na2CO3+ | HCl | =NaCl+NaHCO3 |
106 | 36.5 | |
y | 50g��7.3% |
�� ![]() �����y=10.6g��
�����y=10.6g��
����Ʒ��NaHCO3������Ϊ��19g��10.6g=8.4g��
���Դ��ǣ���1��NaHCO3��NaCl�� ��2������ 8.8�� ��3��7.3%����4��8.4��
�����㾫����������Ŀ����֪���������ø��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ո����ʼ�������=ϵ������Է�������֮�ȣ�

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�����Ŀ���Ա�ѧϰ��һ����Ҫ��ѧϰ������ijС���ͬѧ��CO��CO2�����ʽ����˶Ա�ѧϰ��
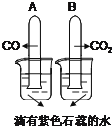
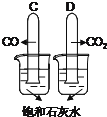
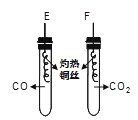
��1������������ʵ�鱨���һ���֣��뽫�䲹��������
ʵ������ | ʵ������ | ��������� |
������CO��CO2���Թܵ����ڵ�����ɫʯ���ˮ�� | A�Թ������������� | ���ۣ� |
������CO��CO2���Թܵ������뱥��ʯ��ˮ�� | C�Թ������������� | ���ۣ� |
���������ȡ�������������ڵ�ͭ˿�ֱ��������CO��CO2���Թ��� | E�пɹ۲쵽���ȵ�ͭ˿���� �� | CO��CuO��Ӧ�Ļ�ѧ����ʽΪ �� |
��2��ͬѧ��ͨ��ʵ��̽�����֣�CO��CO2����̼�������ﵫ����ȴ�кܴ���죬����۽Ƕȷ���ԭ�� ��