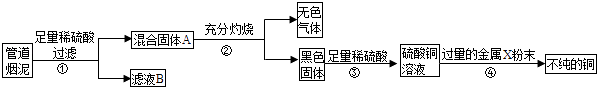
题目内容
【题目】海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.
(1)在t1℃时,向100g水中加入150g MgCl2 , 形成(填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为 .
(2)t1℃ 时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 . 将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有(填字母序号). A.MgCl2和KCl
B.只有MgSO4
C.MgCl2、KCl和MgSO4 . 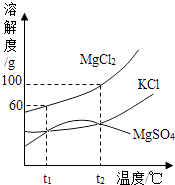
【答案】
(1)饱和;50%
(2)MgCl2;C
【解析】解:(1)t1℃时MgCl2的溶解度是60g,所以向100g水中加入150g MgCl2 , 最多溶解60g溶质,形成饱和溶液,t2℃时MgCl2的溶解度是100g,温度升高到t2℃时溶质依然不能全部溶解,溶质的质量分数是 ![]() ×100%=50%;(2)饱和溶液溶质质量分数的计算方法是:
×100%=50%;(2)饱和溶液溶质质量分数的计算方法是: ![]() ×100%,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体; 故答案为:(1)饱和;50%;(2)MgCl2;C.
×100%,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体; 故答案为:(1)饱和;50%;(2)MgCl2;C.
(1)据t1℃、t2℃时MgCl2的溶解度及溶质的质量分数计算式分析解答(2)根据饱和溶液的质量分数的影响因素和降温后溶解度的变化考虑.

【题目】丽丽同学设计了以下四个实验,其中不合理的是( )
选项 | A | B | C | D |
实验 要求 | 区分羊毛绒和棉线 | 区分食盐水和稀盐酸 | 区分硝酸铵粉末和氧化钙粉末 | 区分聚乙烯和聚氯乙烯 |
方案 | 灼烧闻气味 | 滴加酚酞试液 | 加水 | 灼烧闻气味 |
A. A B. B C. C D. D
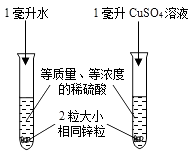
【题目】小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应.硫酸铜溶液是稀硫硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?
(1)他们先进行如图实验,观察到试管B中产生气泡速度快得多,并有暗红色固体生成.A实验的作用是 . 他们认为CuSO4溶液不是催化剂,所依据的实验现象是 .
(2)在6支试管中分别加入2颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示条件进行实验,并测量收集50毫升氢气所用的时间.记录如下:
试管 | A | B | C | D | E | F |
CuSO4溶液/毫升 | 0 | 0.5 | 1 | 1.5 | 2 | 4 |
水/毫升 | 4 | 3.5 | 3 | V1 | V2 | 0 |
收集H2所用的时间/秒 | 348 | 246 | 190 | 165 | 230 | 360 |
1试管D中加入水的体积V1=毫升;
2由上表可得出,CuSO4的溶液的量对稀硫酸与锌反应速率影响的变化趋势是