题目内容
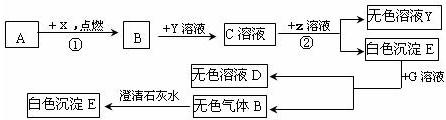
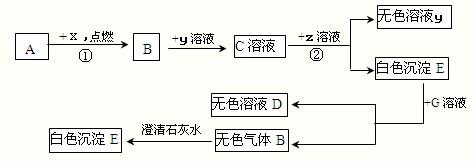
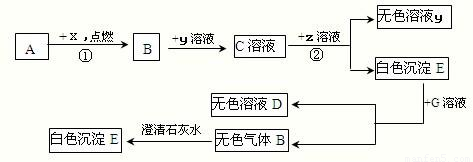
已知下列各物质的相互转化关系如图所示,E是一种常用建筑材料的主要成分,G可帮助消化,ⅹ为气体单质,Y是一种含有钠元素的碱,假设每次反应都恰好完全.
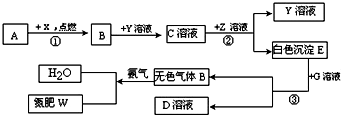
(1)若A是单质,其可能是
(2)写出②处发生反应的化学方程式:
(3)W有四种元素组成,每个分子中的原子个数比为1:1:2:4,相对分子质量为60,其中碳元素质量分数为20%,则W的化学式为

(1)若A是单质,其可能是
碳
碳
(填名称,下同),若A是化合物,则可能是一氧化碳
一氧化碳
.(2)写出②处发生反应的化学方程式:
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
,该反应属于复分解反应
复分解反应
(填反应的基本类型);写出③处发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.(3)W有四种元素组成,每个分子中的原子个数比为1:1:2:4,相对分子质量为60,其中碳元素质量分数为20%,则W的化学式为
(NH2)2CO
(NH2)2CO
.分析:E是一种常用建筑材料的主要成分,G可帮助消化,则E是碳酸钙,G是盐酸,以此为突破口分析解答即可;
解答:解:(1)若A是单质,该单质能够与X反应生成B,B能够与含钠的碱氢氧化钠反应,则A可能是单质的碳,B是二氧化碳,如果A是化合物,则A应该是一氧化碳,只有这样才能生成二氧化碳,并和氢氧化钠反应;
(2)E是常见的建筑材料,且是白色沉淀,所以E是碳酸钙,而C是二氧化碳和氢氧化钠的反应产物,所以C可能是碳酸钠,则Z是氢氧化钙,该反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,它具有两种化合物相互交换成分生成的两种新的化合物的反应特点,所以是复分解反应,反应③是碳酸钙和盐酸的反应(盐酸是胃酸的成分帮助消化),方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)由于W是由四种元素组成,且是由二氧化碳和氨气生成,依据质量守恒定律可知该物质中含有的四种元素是N、H、O、C,该物质的相对分子质量为60,其中碳元素质量分数为20%,则可知该物质的一个分子中含有的碳的质量是12,即含有一个碳原子,设该物质的化学式可以是NxHyOzC,故有14x+y+16z+12=60,14x+y+16z=48,且三个未知数的比是1:2:4,采用组合的方式验证,x=2、y=4、z=1符号题意,故该物质的化学式为(NH2)2CO;
故答案为:(1)碳;一氧化碳;(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;复分解反应;CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)(NH2)2CO;
(2)E是常见的建筑材料,且是白色沉淀,所以E是碳酸钙,而C是二氧化碳和氢氧化钠的反应产物,所以C可能是碳酸钠,则Z是氢氧化钙,该反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,它具有两种化合物相互交换成分生成的两种新的化合物的反应特点,所以是复分解反应,反应③是碳酸钙和盐酸的反应(盐酸是胃酸的成分帮助消化),方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)由于W是由四种元素组成,且是由二氧化碳和氨气生成,依据质量守恒定律可知该物质中含有的四种元素是N、H、O、C,该物质的相对分子质量为60,其中碳元素质量分数为20%,则可知该物质的一个分子中含有的碳的质量是12,即含有一个碳原子,设该物质的化学式可以是NxHyOzC,故有14x+y+16z+12=60,14x+y+16z=48,且三个未知数的比是1:2:4,采用组合的方式验证,x=2、y=4、z=1符号题意,故该物质的化学式为(NH2)2CO;
故答案为:(1)碳;一氧化碳;(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;复分解反应;CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)(NH2)2CO;
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据叙述的关键,以及物质的性质和物质之间的反应,做出判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目