题目内容
 (1)人体中骨骼与牙齿的重要成分是羟基磷酸钙[Ca10(PO4)6(OH)2],羟基磷酸钙由
(1)人体中骨骼与牙齿的重要成分是羟基磷酸钙[Ca10(PO4)6(OH)2],羟基磷酸钙由(2)硫酸、盐酸是重要的化工原料.盐酸的下列用途中,能用硫酸代替盐酸的是
①金属表面除锈 ②制造药物氯化锌 ③除去NaCl中的少量NaOH
(3)镍(Ni)是一种用途广泛的金属,常用于电镀工业和制造电池,硫酸镍溶液显绿色,氢氧化镍为难溶于水的绿色固体.将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液,充分振荡后静置. 写出实验现象:
(4)高温条件下一氧化碳能从磁铁矿石(主要成分为Fe3O4)中将铁还原出来,反应的化学方程式是
(5)硫代硫酸钠(Na2S2O3),俗名大苏打、海波.用途非常广泛,在氧化还原滴定法中做分析试剂.硫代硫酸钠遇稀硫酸有无色刺激性气味气体产生,并生成浅黄色硫沉淀,请写出反应的化学方程式
(6)过氧化氢溶液长期保存会自然分解,小军从家中拿来一瓶久置的医用过氧化氢溶液,取出该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示.则该过氧化氢溶液中溶质的质量分数为
考点:化学式的书写及意义,有关溶质质量分数的简单计算,铁的冶炼,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:化学用语和质量守恒定律,金属与金属材料,常见的酸 酸的通性,常见的碱 碱的通性,综合计算(图像型、表格型、情景型计算题)
分析:(1)根据羟基磷酸钙晶体的化学式的含义进行分析解答即可.
(2)根据酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应),据此结合盐酸与硫酸的化学性质与用途进行分析判断即可.
(3)由题意,硫酸镍溶液显绿色,氢氧化镍为难溶于水的绿色固体,据此进行分析解答.
(4)高温条件下一氧化碳能从磁铁矿石(主要成分为Fe3O4)中将铁还原出来,写出反应的化学方程式即可.
(5)硫代硫酸钠遇稀硫酸有无色刺激性气味气体产生,并生成浅黄色硫沉淀,写出反应的化学方程式即可.
(6)由图示可知,完全反应后生成气体的质量为0.48g;根据过氧化氢溶液分解的化学方程式和生成气体的质量,列出比例式,即可计算出参与反应的H2O2的质量,然后根据质量分数公式计算即可.
(2)根据酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应),据此结合盐酸与硫酸的化学性质与用途进行分析判断即可.
(3)由题意,硫酸镍溶液显绿色,氢氧化镍为难溶于水的绿色固体,据此进行分析解答.
(4)高温条件下一氧化碳能从磁铁矿石(主要成分为Fe3O4)中将铁还原出来,写出反应的化学方程式即可.
(5)硫代硫酸钠遇稀硫酸有无色刺激性气味气体产生,并生成浅黄色硫沉淀,写出反应的化学方程式即可.
(6)由图示可知,完全反应后生成气体的质量为0.48g;根据过氧化氢溶液分解的化学方程式和生成气体的质量,列出比例式,即可计算出参与反应的H2O2的质量,然后根据质量分数公式计算即可.
解答:解:(1)羟基磷酸钙晶体是由钙、磷、氧、氢四种元素组成的.
(2)A、盐酸和硫酸都能与金属表面的锈的主要成分金属氧化物反应,都可用于金属表面去锈,故选项正确.
B、由质量守恒定律,反应前后元素种类不变,则制造药物氯化锌不能使用硫酸,故选项错误.
C、除去NaCl中的少量NaOH,不能使用硫酸,这是因为硫酸能与氢氧化钠溶液反应生成硫酸钠,能除去杂质但引入了新的杂质硫酸钠,不符合除杂原则,故选项错误.
(3)将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液,硫酸镍与氢氧化钠溶液反应生成绿色的氢氧化镍沉淀,生成的硫酸钠溶液显无色,故溶液的颜色要变为无色.
(4)高温条件下一氧化碳能从磁铁矿石(主要成分为Fe3O4)中将铁还原出来,反应的化学方程式是Fe3O4+4CO
3Fe+4CO2.
(5)硫代硫酸钠遇稀硫酸生成硫酸钠、无色刺激性气味气体产生(二氧化硫),并生成浅黄色硫沉淀(硫),由质量守恒定律,反应前后元素种类不变,同时还生成水,反应的化学方程式是Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O.
(6)由图象可知完全反应后生成氧气的质量为0.48g;
设参与反应的H2O2的质量为x,
2H2O2
2H2O+O2↑
68 32
x 0.48g
=
x=1.02g
则该过氧化氢溶液中溶质的质量分数为
×100%=2%.
故答案为:(1)4;(2)①;(3)有绿色沉淀生成,溶液从绿色变成无色;(4)Fe3O4+4CO
3Fe+4CO2;(5)Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O;(6)2%.
(2)A、盐酸和硫酸都能与金属表面的锈的主要成分金属氧化物反应,都可用于金属表面去锈,故选项正确.
B、由质量守恒定律,反应前后元素种类不变,则制造药物氯化锌不能使用硫酸,故选项错误.
C、除去NaCl中的少量NaOH,不能使用硫酸,这是因为硫酸能与氢氧化钠溶液反应生成硫酸钠,能除去杂质但引入了新的杂质硫酸钠,不符合除杂原则,故选项错误.
(3)将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液,硫酸镍与氢氧化钠溶液反应生成绿色的氢氧化镍沉淀,生成的硫酸钠溶液显无色,故溶液的颜色要变为无色.
(4)高温条件下一氧化碳能从磁铁矿石(主要成分为Fe3O4)中将铁还原出来,反应的化学方程式是Fe3O4+4CO
| ||
(5)硫代硫酸钠遇稀硫酸生成硫酸钠、无色刺激性气味气体产生(二氧化硫),并生成浅黄色硫沉淀(硫),由质量守恒定律,反应前后元素种类不变,同时还生成水,反应的化学方程式是Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O.
(6)由图象可知完全反应后生成氧气的质量为0.48g;
设参与反应的H2O2的质量为x,
2H2O2
| ||
68 32
x 0.48g
| 68 |
| 32 |
| x |
| 0.48g |
则该过氧化氢溶液中溶质的质量分数为
| 1.02g |
| 51g |
故答案为:(1)4;(2)①;(3)有绿色沉淀生成,溶液从绿色变成无色;(4)Fe3O4+4CO
| ||
点评:本题难度不大,掌握化学式与化学方程式的书写方法、酸的化学性质与用途、化学方程式与溶质质量分数的综合计算等是正确解答本题的关键.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
擦玻璃时,人们时常向玻璃上“哈气”,再擦会干净,这说明与空气相比,人体呼出的气体中含有较多的( )
| A、氧气 | B、氮气 |
| C、二氧化碳 | D、水蒸气 |
为把2008年北京奥运会举办成“绿色奥运”下列作法不正确的是( )
| A、公交车改用清洁能源 |
| B、治理工地扬尘 |
| C、化工厂废气经处理后排放 |
| D、将垃圾焚烧后处理 |
 是A、B两种物质的溶解度曲线,据图回答:
是A、B两种物质的溶解度曲线,据图回答: 已知Na2CO3的水溶液呈碱性,在一烧杯中盛有31.4g Na2CO3溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
已知Na2CO3的水溶液呈碱性,在一烧杯中盛有31.4g Na2CO3溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: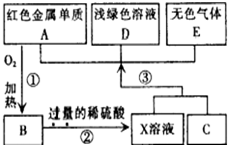 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答: