题目内容
【题目】锰是治炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有 FeCO3、NiCO3等杂质)为原料生产金属锰的工艺流程如下图,请回答以下问题:
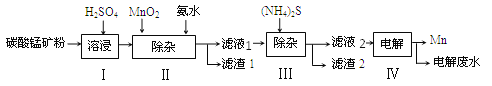
(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是_______,其中碳酸锰与硫酸反应的化学方程式为_________________。
(2)步骤Ⅱ中,先加入二氧化锰发生以下反应:MnO2+2FeSO4+2H2SO4=MnSO4+2H2O+x,x的化学式为______;已知滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,则步骤Ⅱ中加入氨水的主要目的是________。
(3)步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,则滤渣2中主要成分为______(填化学式)
(4)步骤Ⅳ中,电解后的废液中还含有Mn2+,常用石灰乳进行一级沉降得到沉淀Mn(OH)2和氨气,过滤后,再向滤液中加入Na2S进行二级沉降得到沉淀MnS。写出二级沉降过程中发生的化学反应方程式:___________________;沉降过程的产物中,______________________可循环利用于上述流程。
【答案】 增加反应物之间的接触面积,使反应更充分,同时加快反应速率 MnCO3 + H2SO4 = MnSO4 + H2O + CO2 ↑ Fe2(SO4)3 除去铁离子 NiS MnSO4+ Na2S = Na2SO4 + MnS↓ 氨气
【解析】(1)根据将碳酸锰矿研磨成粉末的主要目的是增加反应物之间的接触面积,使反应更充分,同时加快反应速率解答;根据碳酸锰与硫酸反应生成硫酸锰、水、二氧化碳解答;(2)根据质量守恒定律分析解答;根据滤液1中不含铁离子解答;(3)根据滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,NiSO4与加入的(NH4)2S反应分析解答;(4)根据MnSO4与Na2S反应,生成Na2SO4 和 MnS解答;根据题中信息可知,有氨气生成,氨气可通入步骤Ⅱ循环利用解答。(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是增加反应物之间的接触面积,使反应更充分,同时加快反应速率;碳酸锰与硫酸反应生成硫酸锰、水、二氧化碳,反应的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2 ↑;(2)反应前Mn、O、Fe、SO42-、H个数为1、2、2、4、4,反应后Mn、O、Fe、SO42-、H个数为1、2、0、1、4,反应前后Fe相差2个,SO42-相差3个,又x前的化学计量数为1,故x的化学式为Fe2(SO4)3;又滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,不含Fe2(SO4)3,则步骤Ⅱ中加入氨水的主要目的是除去铁离子;(3) 滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,又步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,故NiSO4与加入的(NH4)2S反应,反应的化学方程式为NiSO4+(NH4)2S=(NH4)2SO4+ NiS↓,故滤渣2中主要成分为NiS;(4)MnSO4与Na2S反应,生成Na2SO4 和 MnS,反应的化学方程式为MnSO4+Na2S=Na2SO4 + MnS↓;由题中信息可知,有氨气生成,故氨气可循环利用于上述流程。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案