题目内容
如图是我们熟悉的实验室制取气体的发生装置、收集装置以及净化装置请根据题意回答以下问题.
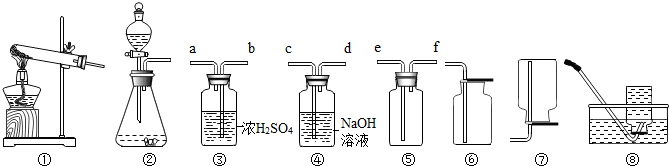
(1)在初中可同时用来制取O2、CO2和H2的发生装置是 (填字母).
(2)写出实验室用高锰酸钾制氧气的化学方程式 .
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,也能加快KClO3的分解.用文字说明其原因
(4)小华同学用浓盐酸与大理石反应,制取二氧化碳并检验其有关性质,二氧化碳通入紫色石蕊试液中观察紫色石蕊试液变红,对这一现象的解释不合理是 (填序号).
a.产生的CO2直接使石蕊试液变红 c.挥发出的氯化氢溶于水,使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
(5)如果制得的氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,需要通过③
和④装置,则装置按导管字母连接的顺序是:发生装置→ → → →
→收集装置(填字母).
(6)若要检验氢气中的杂质HCl,可把④装置中的试剂换成 (填化学式)溶液,实验中观察到有白色沉淀生成,写出相应的化学方程式 .
(5)图中的⑤装置是一个用排空气法收集氢气的装置,请你判断气体应由 进 出 (填字母).

(1)在初中可同时用来制取O2、CO2和H2的发生装置是
(2)写出实验室用高锰酸钾制氧气的化学方程式
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,也能加快KClO3的分解.用文字说明其原因
(4)小华同学用浓盐酸与大理石反应,制取二氧化碳并检验其有关性质,二氧化碳通入紫色石蕊试液中观察紫色石蕊试液变红,对这一现象的解释不合理是
a.产生的CO2直接使石蕊试液变红 c.挥发出的氯化氢溶于水,使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
(5)如果制得的氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,需要通过③
和④装置,则装置按导管字母连接的顺序是:发生装置→
(6)若要检验氢气中的杂质HCl,可把④装置中的试剂换成
(5)图中的⑤装置是一个用排空气法收集氢气的装置,请你判断气体应由
考点:常用气体的发生装置和收集装置与选取方法,常见气体的检验与除杂方法,实验室制取氧气的反应原理,二氧化碳的实验室制法,二氧化碳的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)制取O2可用二氧化锰和过氧化氢反应;制取CO2可用大理石和稀盐酸反应;制取H2可用锌和稀硫酸反应;均属于固液常温型反应;
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气;
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,KMnO4分解生成的MnO2也能加快KClO3的分解.
(4)紫色石蕊试液遇酸变红色;
(5)氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,应先除杂再干躁;
(6)AgCl与HCl反应生成AgCl沉淀和HNO3;
(7)用排空气法收集氢气的装置的选择,应考虑氢气的密度.
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气;
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,KMnO4分解生成的MnO2也能加快KClO3的分解.
(4)紫色石蕊试液遇酸变红色;
(5)氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,应先除杂再干躁;
(6)AgCl与HCl反应生成AgCl沉淀和HNO3;
(7)用排空气法收集氢气的装置的选择,应考虑氢气的密度.
解答:解:
(1)制取O2可用二氧化锰和过氧化氢反应;制取CO2可用大理石和稀盐酸反应;制取H2可用锌和稀硫酸反应;均属于固液常温型反应;因此在初中可同时用来制取O2、CO2和H2的发生装置是②;
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气;实验室用高锰酸钾制氧气的化学方程式:2KMnO4
K2MnO4+MnO2+O2↑;
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,KMnO4分解生成的MnO2也能加快KClO3的分解,故应填写:KMnO4加热分解生成的MnO2对KClO3制氧气起到了催化剂的作用;
(4)用浓盐酸与大理石反应,制取二氧化碳并检验其有关性质,二氧化碳通入紫色石蕊试液中观察紫色石蕊试液变红,因为紫色石蕊试液遇酸变红色,所以对这一现象的解释不合理是a;
(5)氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,应先除杂再干躁;故应填写:cdba;
(6)AgCl与HCl反应生成AgCl沉淀和HNO3;故应填写:AgCl;AgNO3+HCl=AgCl↓+HNO3;
(7)用排空气法收集氢气的装置的选择,应考虑氢气的密度;因为氢气的密度比空气小,故判断气体应由f进e出.
故本题答案为:
(1)②;
(2)2KMnO4
K2MnO4+MnO2+O2↑;
(3)KMnO4加热分解生成的MnO2对KClO3制氧气起到了催化剂的作用;
(4)a;
(5)cdba;
(6)AgCl;AgNO3+HCl=AgCl↓+HNO3;
(7)f;e;
(1)制取O2可用二氧化锰和过氧化氢反应;制取CO2可用大理石和稀盐酸反应;制取H2可用锌和稀硫酸反应;均属于固液常温型反应;因此在初中可同时用来制取O2、CO2和H2的发生装置是②;
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气;实验室用高锰酸钾制氧气的化学方程式:2KMnO4
| ||
(3)用KClO3制氧气需加MnO2作催化剂.若在KClO3中加少量的KMnO4,KMnO4分解生成的MnO2也能加快KClO3的分解,故应填写:KMnO4加热分解生成的MnO2对KClO3制氧气起到了催化剂的作用;
(4)用浓盐酸与大理石反应,制取二氧化碳并检验其有关性质,二氧化碳通入紫色石蕊试液中观察紫色石蕊试液变红,因为紫色石蕊试液遇酸变红色,所以对这一现象的解释不合理是a;
(5)氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,应先除杂再干躁;故应填写:cdba;
(6)AgCl与HCl反应生成AgCl沉淀和HNO3;故应填写:AgCl;AgNO3+HCl=AgCl↓+HNO3;
(7)用排空气法收集氢气的装置的选择,应考虑氢气的密度;因为氢气的密度比空气小,故判断气体应由f进e出.
故本题答案为:
(1)②;
(2)2KMnO4
| ||
(3)KMnO4加热分解生成的MnO2对KClO3制氧气起到了催化剂的作用;
(4)a;
(5)cdba;
(6)AgCl;AgNO3+HCl=AgCl↓+HNO3;
(7)f;e;
点评:本题考查了气体的发生装置和收集装置的选择方法,氧气的制取原理和催化剂的知识,二氧化碳的性质,除杂的原理和原则及氢气的性质等,熟练掌握所学知识,难度不是很大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
“天宫一号”与“神州八号”飞船的完美对接展示了我国的航天水平.“天宫一号”上的重要部件太阳能帆板使用的高纯硅制备原理是:2H2+SiCl4=Si+4HCl.该反应属于( )
| A、化合反应 | B、置换反应 |
| C、分解反应 | D、复分解反应 |
下列物质排放到空气中,不污染空气的是( )
| A、氧气 | B、一氧化碳 |
| C、二氧化氮 | D、二氧化硫 |
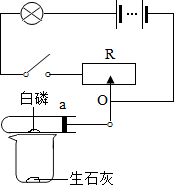 如图所示装置,O点是一固定点,试管内活塞初始位置在a处,活塞连接金属滑片,活塞运动滑动变阻器阻值随之改变.试管内是空气和足量的白磷,烧杯中盛放足量生石灰.闭合开关小灯泡发光,向烧杯中加入滴有酚酞试液的水,试推测:
如图所示装置,O点是一固定点,试管内活塞初始位置在a处,活塞连接金属滑片,活塞运动滑动变阻器阻值随之改变.试管内是空气和足量的白磷,烧杯中盛放足量生石灰.闭合开关小灯泡发光,向烧杯中加入滴有酚酞试液的水,试推测:

 现有A~F六种常见物质,其中A、B、C分属于酸碱盐中的一类物质,D是一种重要的温室气体,D、E、F都含有同种非金属元素,它们的关系如图,短线相连的物质间能反应,箭头表示物质间的转化关系.请回答:(1)写出D物质的化学式:
现有A~F六种常见物质,其中A、B、C分属于酸碱盐中的一类物质,D是一种重要的温室气体,D、E、F都含有同种非金属元素,它们的关系如图,短线相连的物质间能反应,箭头表示物质间的转化关系.请回答:(1)写出D物质的化学式: