题目内容
(2013?酒泉)请你根据所学知识并结合如图所示装置回答下列问题.
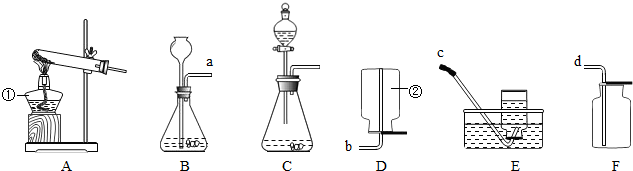
(1)写出图中标有①、②的仪器名称:①
(2)用高锰酸钾制取氧气的化学方程式为
(3)装置B和装置C相比较,装置C的优点是
(4)晓华同学用大理石和稀盐酸反应制取二氧化碳气体,他应选择的发生装置是

(1)写出图中标有①、②的仪器名称:①
酒精灯
酒精灯
、②集气瓶
集气瓶
.(2)用高锰酸钾制取氧气的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,发生装置应选
| ||
A
A
,若收集氧气选择装置E,什么时候开始收集最佳?气泡连续均匀冒出时收集
气泡连续均匀冒出时收集
,集满氧气的集气瓶应正
正
(填“正”或“倒)放在桌面上,停止制气时应进行的操作是移出导气管后熄灭酒精灯
移出导气管后熄灭酒精灯
.(3)装置B和装置C相比较,装置C的优点是
可以控制反应的速度
可以控制反应的速度
.(4)晓华同学用大理石和稀盐酸反应制取二氧化碳气体,他应选择的发生装置是
B
B
,收集装置是F
F
.分析:(1)熟练掌握常见的化学仪器名称和用途;
(2)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,根据化学方程式的书写步骤书写方程式;根据加热高锰酸钾制氧气的反应物的状态和反应条件选择发生装置及用排水法收集时的注意事项、实验的步骤和氧气的密度进行分析解答;
(3)比较装置B和装置C的不同点结合分液漏斗的作用分析装置的优点;
(4)用大理石和稀盐酸反应制取二氧化碳气体的反应物的状态和反应条件选择发生装置,根据二氧化碳的密度和溶解性选择收集方法.
(2)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,根据化学方程式的书写步骤书写方程式;根据加热高锰酸钾制氧气的反应物的状态和反应条件选择发生装置及用排水法收集时的注意事项、实验的步骤和氧气的密度进行分析解答;
(3)比较装置B和装置C的不同点结合分液漏斗的作用分析装置的优点;
(4)用大理石和稀盐酸反应制取二氧化碳气体的反应物的状态和反应条件选择发生装置,根据二氧化碳的密度和溶解性选择收集方法.
解答:解:(1)①是酒精灯;②是集气瓶;
(2)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,因此反应的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑;
发生装置的特点属于固体加热型的A装置;
用排水法收集氧气的合适时机是:气泡连续均匀冒出时收集,以防收集的氧气不纯;
因为氧气的密度比空气大,为了防止氧气的溢出,因此集气瓶应该正放在桌面上;
制备氧气结束时应该先移出导气管再熄灭酒精灯,否则会因为试管骤冷而引起水的倒流使试管炸裂;
(3)装置C的分液漏斗可以控制液体的流速,从而能够控制反应的速率;
(4)实验室制取二氧化碳的药品是石灰石或大理石和稀盐酸,属于固体和液体在常温下的反应,因此应选用的发生装置是B;因为二氧化碳易溶于水,密度比空气大,故收集装置F(向上排空气法);
故答案为:(1)酒精灯;集气瓶;
(2)2KMnO4
K2MnO4+MnO2+O2↑;A;气泡连续均匀冒出时收集;正;先移出导气管后熄灭酒精灯;
(3)可以控制反应的速度;
(4)B;F.
(2)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,因此反应的化学方程式为:2KMnO4
| ||
发生装置的特点属于固体加热型的A装置;
用排水法收集氧气的合适时机是:气泡连续均匀冒出时收集,以防收集的氧气不纯;
因为氧气的密度比空气大,为了防止氧气的溢出,因此集气瓶应该正放在桌面上;
制备氧气结束时应该先移出导气管再熄灭酒精灯,否则会因为试管骤冷而引起水的倒流使试管炸裂;
(3)装置C的分液漏斗可以控制液体的流速,从而能够控制反应的速率;
(4)实验室制取二氧化碳的药品是石灰石或大理石和稀盐酸,属于固体和液体在常温下的反应,因此应选用的发生装置是B;因为二氧化碳易溶于水,密度比空气大,故收集装置F(向上排空气法);
故答案为:(1)酒精灯;集气瓶;
(2)2KMnO4
| ||
(3)可以控制反应的速度;
(4)B;F.
点评:本题考查了常见气体的制取装置、收集方法等的选择及实验的注意事项,并在此基础上进行对装置的评价,关键是明确发生装置、收集方法选择的依据.

练习册系列答案
相关题目