题目内容
【题目】下列图象能正确反映对应变化关系的是
A. 向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系
B. 向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量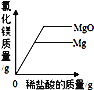
C. 向等质量等质量分数的稀硫酸中分别加入锌粉和铁粉
D. 向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
【答案】D
【解析】
A、氢氧化钠溶液呈碱性,加水后碱性减弱,pH减小,无论怎样加水,其pH总是大于7,不会小于7,故A错误;
B、Mg+2HCl═MgCl2+H2↑,MgO+2HCl═MgCl2+H2O,观察二者的方程式可知,
 由此分析可知,等质量的镁和氧化镁与足量的稀盐酸反应,镁生成的氯化镁更多,图像与之不符,故B错误;
由此分析可知,等质量的镁和氧化镁与足量的稀盐酸反应,镁生成的氯化镁更多,图像与之不符,故B错误;
C、根据化学方程式:Zn + H2SO4 === ZnSO4 + H2↑,Fe + H2SO4 === FeSO4 + H2↑可知,每65份质量的锌与98份质量的硫酸反应,可生成2份质量的氢气,每56份质量的铁与98份质量的硫酸反应,可生成2份质量的氢气;相同质量的硫酸,产生的氢气质量相等;生成氢气的质量相同时消耗的锌要比铁的质量多,图像与之不符,故C错误;
D、向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液,氢氧化钠会先与硫酸反应,然后硫酸铜再与氢氧化钠反应,不会立即出现沉淀,当硫酸铜反应完后,沉淀的质量不再增加,图像与之相符,故D正确。故选D。

练习册系列答案
相关题目






