题目内容
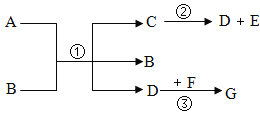
【题目】已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体, E在纯净的B中燃烧发出明亮的蓝紫色火焰。

(1)请写出下列物质的化学式:D________,E________,G________,H________。
(2)请写出下列变化的化学方程式:
①B→F,___________________。
②A→C,___________________。
③B→G,___________________。
【答案】C S SO2 H2 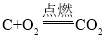
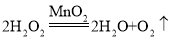
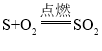
【解析】
由图知A、C是无色液体且在二氧化锰的作用下A能生成C,所以A是过氧化氢溶液,C是水,B是氧气;C在通电的条件下生成B和H,则H为氢气,F能引起温室效应,则F通常是二氧化碳,D是黑色固体,则能与氧气反应生成二氧化碳的黑色固体是碳,E在纯净的B中燃烧发出明亮的蓝紫色火焰则E是硫,因为硫在氧气中燃烧能产生蓝紫色火焰则生成的G是二氧化硫。代入验证全部正确。
(1)由分析知:D是碳,化学式为C;E是硫,化学式为S;G是二氧化硫,化学式为SO2;H是氢气,化学式为H2,故填:C S SO2 H2
(2)①由分析知B→F的反应是碳与氧气生成二氧化碳的反应,所以化学方程式为: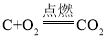 。
。
②由分析知A→C的反应是过氧化氢在二氧化锰的催化作用下生成水和氧气的反应,所以化学方程式为: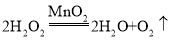 。
。
③由分析知B→G的反应是硫与氧气反应生成二氧化硫的反应,所以化学方程式为: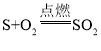

【题目】材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
(一)实验室用赤铁矿模拟工业炼铁的化学方程式为_____,炼得的铁是_____(填“单质铁”或“合金”),该反应_____(填“是”或“不是”)置换反应。
(二)FeCO3是菱铁矿的主要成分,具有还原性,在空气中灼烧生成铁的氧化物和CO2气体。要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与小华同学的探究:
(查阅资料)
① FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水。
②FeCl2能使高锰酸钾溶液褪色,而FeCl3不能;FeCl3溶液中滴加KSCN溶液,溶液变红色,FeCl2溶液中滴加KSCN溶液,溶液不出现红色。
(猜想与假设)
猜想1:固体成分是氧化铁;
猜想2:固体成分是四氧化三铁;
猜想3:_____。
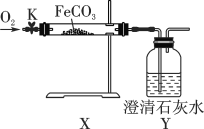
(活动与探究)连接仪器、装好药品如图所示(加热和固定装置已省略),打开止水夹K,通入氧气,加热玻璃管X。当Y瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。取玻璃管里的少量固体于试管中,滴加盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验。
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(结论与反思)
(1)由上述实验现象可知,FeCO3在氧气中高温灼烧得到的固体产物是_____,因此,猜想_____(填“1”“2”或“3”)是正确的。
(2)FeCO3在氧气中高温灼烧的化学方程式为_____。
(3)上述实验_____(填“a”或“b”)是多余的,因为_____。
(总结与提升)
(1)若实验结束时观察到Y瓶中仍然是澄清的,可能的原因是澄清石灰水的量不足,导致生成的碳酸钙转变成了可溶于水的碳酸氢钙。碳酸氢钙的化学式为_____。
(2)CO2使澄清石灰水变浑浊的化学方程式为_____。
(3)华雪同学经过反思,觉得该实验设计还存在问题,因为如果在实验b中观察到_____,就不能确定哪个猜想是正确的。所以小华同学又对该实验进行了定量探究:取11.6 g纯净的碳酸亚铁固体,在空气中高温灼烧至恒重,称得固体质量净减3.6 g。通过计算即可确定:FeCO3和氧气充分反应后的固体成分是_____。