题目内容
(2005?益阳)将一块锌铜合金投入74.2g稀H2SO4中,恰好完全反应,生成氢气0.2g.求:(1)反应后所得溶液的溶质质量分数;
(2)实验室现有98%的浓硫酸20g,需要多少克水才能配制成19.6%的稀硫酸?
【答案】分析:(1)根据金属活动性可知合金中只有锌可与稀硫酸发生反应放出氢气,恰好完全反应后的溶液为硫酸锌溶液;根据反应的化学方程式,由生成氢气质量计算生成硫酸锌的质量和参加反应锌的质量;利用质量守恒定律,计算反应后所得溶液质量,由硫酸锌与溶液质量比可计算反应后所得溶液的溶质质量分数;
(2)根据加水稀释前后溶质硫酸质量不变,可以直接求算溶液质量或者加入水的质量.
解答:解:(1)设合金中Zn的质量为x,所得溶液中ZnSO4的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
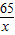 =
=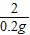 x=6.5g
x=6.5g
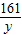 =
=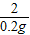 y=16.1g
y=16.1g
所得ZnSO4溶液中溶质质量分数=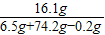 ×100%=20%
×100%=20%
(2)设需要水的质量为z,则
20g×98%=(z+20g)×19.6%
z=80g
答:(1)所得溶液的溶质质量分数为20%;(2)需要80g水.
点评:利用质量守恒定律,恰好完全反应后所得溶液的质量=参加反应锌的质量+所加入稀硫酸溶液的质量-反应放出氢气的质量.
(2)根据加水稀释前后溶质硫酸质量不变,可以直接求算溶液质量或者加入水的质量.
解答:解:(1)设合金中Zn的质量为x,所得溶液中ZnSO4的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
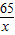 =
=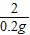 x=6.5g
x=6.5g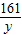 =
=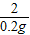 y=16.1g
y=16.1g所得ZnSO4溶液中溶质质量分数=
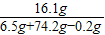 ×100%=20%
×100%=20%(2)设需要水的质量为z,则
20g×98%=(z+20g)×19.6%
z=80g
答:(1)所得溶液的溶质质量分数为20%;(2)需要80g水.
点评:利用质量守恒定律,恰好完全反应后所得溶液的质量=参加反应锌的质量+所加入稀硫酸溶液的质量-反应放出氢气的质量.

练习册系列答案
相关题目