题目内容
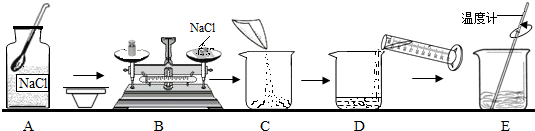
下图是称量固体质量装置图,回答下列问题:
(1)通常使用______(填“图1”或“图2”)称量物质质量;
(2)用图1称量2g食盐,发现指针向左偏转时,这时应______;
(3)某人用图2装置称量5.2克食盐时(1克以下用游码),所称食盐的实际质量为______;
A、4.8克 B、5.2克 C、5.0克 D、5.1克
(4)改正图3中的错误:______.
【答案】分析:天平的使用原则是根据人们方便操作规定的,如果不注意注意事项会使称量结果造成相应的误差.
解答:解:(1)人们在操作时,一般右手比较灵活,所以左物右码方便人们用右手添加砝码,又因为氢氧化钠具有腐蚀性不能直接放到托盘里,所以图1正确;
(2)由于学生用托盘天平称取2g药品,所以在右盘放上2g砝码,再向左盘放药品,所以发现指针向左偏,说明药品多,要减少药品;
(3)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物体质量=砝码质量-游码质量,即:物体质量=5.0 g-0.2 g=4.8 g;
(4)易腐蚀或易潮解的药品必须放到玻璃器皿中.
故答案为:(1)图1;(2)减少食盐;(3)A;(4)用玻璃器皿盛装氢氧化钠固体进行称量.
点评:在称量一定质量的药品时,在称量中发现天平发生偏向时,要么加药品,要么减药品,不能动砝码或游码.
解答:解:(1)人们在操作时,一般右手比较灵活,所以左物右码方便人们用右手添加砝码,又因为氢氧化钠具有腐蚀性不能直接放到托盘里,所以图1正确;
(2)由于学生用托盘天平称取2g药品,所以在右盘放上2g砝码,再向左盘放药品,所以发现指针向左偏,说明药品多,要减少药品;
(3)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物体质量=砝码质量-游码质量,即:物体质量=5.0 g-0.2 g=4.8 g;
(4)易腐蚀或易潮解的药品必须放到玻璃器皿中.
故答案为:(1)图1;(2)减少食盐;(3)A;(4)用玻璃器皿盛装氢氧化钠固体进行称量.
点评:在称量一定质量的药品时,在称量中发现天平发生偏向时,要么加药品,要么减药品,不能动砝码或游码.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目

 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。







 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。