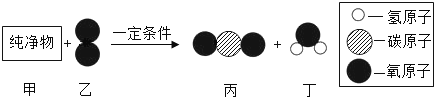
题目内容
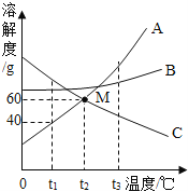
【题目】如图是甲、乙两种物质的溶解度曲线,请结合该图1回答问题:

(1)_____℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是_____(填“甲”或者“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是_____。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数_____(填“大于”“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行如图实验:
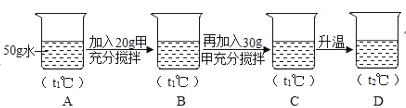
①实验过程中,B、C、D对应的溶液为不饱和溶液的是_____。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是_____。
③两种物质溶解度关系为乙>甲时的温度为t,由图可知t的取值范围是_____。
【答案】t1 乙 降温结晶 大于 B 甲固体溶于水温度升高 0<t<t1℃
【解析】
(1)根据甲、乙两种物质的溶解度曲线可知,在t1℃时,甲、乙两种物质的溶解度相等。
(2)由溶解度曲线可知:甲固体物质的溶解度随温度的升高而增大,而乙的溶解度随温度的升高而减小。
(3)由于甲固体物质的溶解度随温度的升高而增大,可使甲物质从其饱和溶液中结晶析出的方法是降温结晶。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲的溶解度减小,溶液的溶质质量分数减小,乙的溶解度增大,溶质质量分数不变,由于t1℃时甲的溶解度大于t2℃时乙的溶解度,所以t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数大于乙溶液的溶质质量分数。
(5)①t1℃时甲是溶解度是65g,则50g水最多能溶解32.5g甲,所以B是不饱和溶液,C是饱和溶液,t2℃时,甲的溶解度是90g,则50g水中最多能溶解45g甲,D是饱和溶液。
②t1℃时,50g水最多能溶解32.5g甲,向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出原因是:甲固体溶于水放出热量,温度升高,导致溶解度变大;③由溶解度曲线可知,t1℃时甲、乙的溶解度相等,低于t1℃时的某一温度,甲的溶解度小于乙的溶解度,所以t的取值范围是0<t<t1℃。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
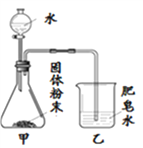
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物________。