题目内容
实验室有一瓶存放时间较长的氢氧化钠溶液,其中一部分已转化成了碳酸钠.取该药品50.6g溶于200g水中,慢慢滴入17.1%的氢氧化钡溶液,当用去氢氧化钡溶液100g时,碳酸钠恰好全部转化为沉淀,过滤取滤液.试求:(1)50.6g样品中碳酸钠的质量.
(2)滤液中溶质的质量.
(3)滤液中溶质的质量分数(计算结果精确到0.1%).
【答案】分析:(1)根据氢氧化钡的质量,利用碳酸钠与氢氧化钡的反应求出碳酸钠的质量即可.
(2)溶液中氢氧化钠的质量等于原固体中氢氧化钠的质量与反应生成的氢氧化钠的质量之和,根据氢氧化钡质量求出生成的氢氧化钠的质量.
(3)溶液的质量等于混合前的物质的总质量与生成沉淀的质量之差,根据溶质的质量分数计算分式求解.
解答:解:设50.6克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成BaCO3的质量为z.
Na2CO3+Ba(OH)2 =BaCO3↓+2NaOH
106 171 197 80
x 100g×17.1% z y
(1)
x=10.6g
(2)
y=8g
样品中氢氧化钠的质量=50.6g-10.6g=40g
所以滤液中溶质的质量=40g+8g=48g
(3)
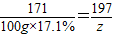
z=19.7g
滤液中溶质的质量分数= ×100%=14.5%
×100%=14.5%
答:(1)50.6g样品中碳酸钠的质量为10.6g
(2)滤液中溶质的质量为48g
(3)滤液中溶质的质量分数为14.5%
故答案为:(1)10.6g(2)48g(3)14.5%
点评:此题是一道化学方程式的计算题,解题的关键是能够对相关的反应的掌握,理清反应的思路结合化学方程式的计算是解题的关键.
(2)溶液中氢氧化钠的质量等于原固体中氢氧化钠的质量与反应生成的氢氧化钠的质量之和,根据氢氧化钡质量求出生成的氢氧化钠的质量.
(3)溶液的质量等于混合前的物质的总质量与生成沉淀的质量之差,根据溶质的质量分数计算分式求解.
解答:解:设50.6克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成BaCO3的质量为z.
Na2CO3+Ba(OH)2 =BaCO3↓+2NaOH
106 171 197 80
x 100g×17.1% z y
(1)

x=10.6g
(2)

y=8g
样品中氢氧化钠的质量=50.6g-10.6g=40g
所以滤液中溶质的质量=40g+8g=48g
(3)
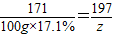
z=19.7g
滤液中溶质的质量分数=
 ×100%=14.5%
×100%=14.5%答:(1)50.6g样品中碳酸钠的质量为10.6g
(2)滤液中溶质的质量为48g
(3)滤液中溶质的质量分数为14.5%
故答案为:(1)10.6g(2)48g(3)14.5%
点评:此题是一道化学方程式的计算题,解题的关键是能够对相关的反应的掌握,理清反应的思路结合化学方程式的计算是解题的关键.

练习册系列答案
相关题目