题目内容
【题目】地球上物质种类千差万别,但都有一定的规律可寻:
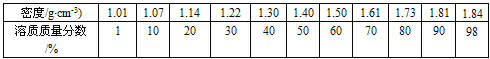
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃-30 ℃)

请你分析上述两个表中的内容,并探究下列问题:
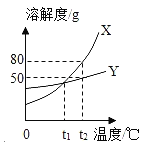
(1)由表一可得出的规律是:__________________________。
(2)由表二可得出两种物质溶解度差异的规律是:_________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:___________________________。
(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
(5)列式并计算出20度时氯化钠的溶质的质量分数:________________(保留1位小数)
【答案】(1)溶质质量分数越大,溶液密度越大(2)有的物质(如NaCl)的溶解度随温度变化不大,而有的物质(如Na2CO3)的溶解度随温度升高而增大(3)因为Na2CO3的的溶解度随温度升高而增大,而NaCl的溶解度受温度影响较小,因此冬天气温较低,而夏天气温高,利用降温结晶析出的是Na2CO3晶体,利用蒸发结晶析出的NaCl (4)变小(1分)(5)36g/100g+36g*100%=26.5%
【解析】
试题分析:(1)从图中可以看出,硫酸溶液的密度越大,溶液的溶质质量分数越大.故答案为:溶液密度随溶质质量分数增大而增大.
(2)从图中可以看出,氯化钠的溶解度随温度的升高而改变不大,而碳酸钠的溶解度随温度的升高而增大.故答案为:氯化钠的溶解度随温度变化不大,而Na2CO3的溶解度随温度变化较大.
(3)由于氯化钠和碳酸钠的溶解度受温度影响不同,Na2CO3的的溶解度随温度升高而增大,而NaCl的溶解度受温度影响较小,因此冬天气温较低,而夏天气温高,利用降温结晶析出的是Na2CO3晶体,利用蒸发结晶析出的NaCl所以那里的农民“冬天捞碱、夏天晒盐”.
(4)向氯化钠溶液中加适量氯化钠晶体,溶液的密度增大,产生的浮力增大,故弹簧秤的示数将变小
(5)20度时氯化钠的溶解度为36g,故溶质质量分数为36g/(100g+36g)*100%=26.5%

 阅读快车系列答案
阅读快车系列答案【题目】氨水是氨气(化学式为NH3)溶于水后形成的,是一种常见的实验药品,它能使无色的酚酞溶液变成红色。
(1)氨气可以用氮气和氢气反应制得,反应的符号表达式为 (不要求注明条件).
(2)氨气溶于水产生了新物质,证明方案如下(请填写表中的空白):
实 验 操 作 | 实 验 现 象 及 结 论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥的氨气的集气瓶中。 | 无明显现象 |
_____________________,放入盛有干燥的氨气的集气瓶中。 | _______________,说明氨气溶于水生成了新物质。 |

(3)探究分子运动的实验:如图所示,将滴有酚酞试液的滤纸放在试管中,试管口塞上一团脱脂棉。
① 用仪器A吸取浓氨水,滴在脱脂棉上(10~15滴)。A的名称是_________,其用途是__________。
② 实验中可以观察到:酚酞试液从 往 依次变红,这说明了___ ____。(用分子的观点解答)
③ 实验中,往往在试管下放一张白纸,白纸的作用是_____________。
④ 某同学做此实验时,发现滤纸条上没有变色,而试管口的脱脂棉却变成了红色,导致这种现象产生的错误操作可能是________________________,
过一段时间后,脱脂棉上的红色又变淡,可能的原因是_______________。
【题目】结合下列实验装置图回答问题:
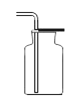
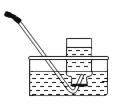
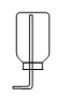

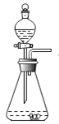
A B C D E F
(1)实验室选用A装置来制取氧气,发生反应方程式为 。若用A和F装置制取氧气,当实验结束时,有同学先熄灭了酒精灯,忘记将导管从水中取出,在水未进入导管之前,可采取的补救措施是 。
(2)实验室选用B装置来制取氧气,则发生反应方程式为 ,若装置B反应很剧烈,据此提出实验安全注意事项是 。(请填写序号)
①控制滴液速度;②用小体积的锥形瓶;③加热反应物;④降低反应物浓度
(3)实验室制备CO2的化学方程式为: 。采用装置C相对于装置B在操作方面的优势为: 。装置C气密性检查的方法是: 。
(4)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率。 | CO2密度比空气大,且① |
收集过程分析 | 集满现象② | “验满”分析:因气体无色,故集满与否较难确定。即便用燃着的木条移近容器口火焰熄灭,也难以证明空气完全排尽。 |

(5)实验室常用加热硫酸铵和熟石灰两种固体混合物来制取氨气。氨气极易溶于水,且密度比空气小,获取氨气的组合装置应选用 (从装置A~F中选择)。若使用右下图所示装置收集氨气,则气体应从 (填“a”或“b”)通入。