题目内容
【题目】如图为某化学反应的微观示意图,请回答。
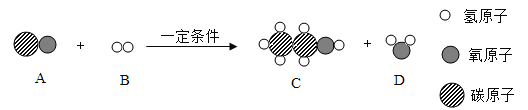
(1)在上述反应中不变的粒子是_____(填“分子”或“原子”)。
(2)在A、B、C、D中属于单质的是_____(填字母)。
(3)一个D分子是由_____构成的。
(4)写出该反应的化学方程式_____。
【答案】原子 B 二个氢原子和一个氧原子 2CO+4H2 C2H5OH+H2O
C2H5OH+H2O
【解析】
(1)由微粒的变化可知,在上述反应中不变的粒子是原子;
(2)由微粒的构成可知,在A、B、C、D中B的分子是由同种的原子构成的,属于单质;
(3)由微粒的构成可知,一个D分子是由二个氢原子和一个氧原子构成的;
(4)由化学反应的微观示意图可知,该反应是氢气和一氧化碳在一定条件下生成了乙醇和水,化学方程式是:2CO+4H2 C2H5OH+H2O。
C2H5OH+H2O。

 每日10分钟口算心算速算天天练系列答案
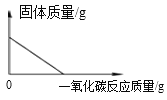
每日10分钟口算心算速算天天练系列答案【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题。他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将2g氯酸钾加热至熔化,伸入带火星的木条, | 木条复燃 | 氯酸钾受热分解能产生氧气,但是_____。 反应的化学方程式为:
| 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条 | 木条不复燃 | ______________ | |
实验三 | _____________ | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | |
(1)请你帮小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是____________;
(3)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是__________;
第二方面的实验是要_______。
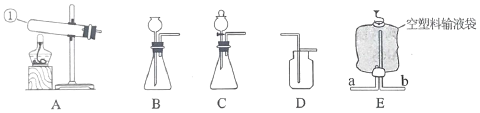
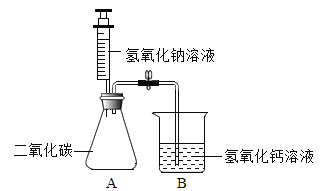
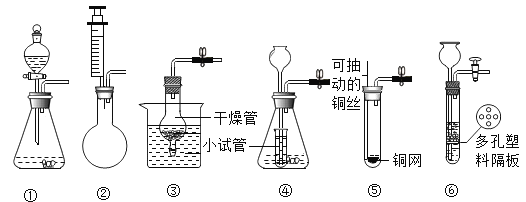
【题目】通过一个月的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。
(1)写出图中标示的仪器的名称:①_________,②____________。
(2)实验室用KMnO4制取O2,应选用的发生装置为______(填字母序号,下同),收集装置可选用F或______,取用KMnO4药品时,应选用仪器______(写仪器名称),写出该反应的文字表达式________。
(3)检查装置E的气密性方法有多种,下列方法和现象能说明该装置不漏气的是______(填序号)。
A 用弹簧夹封闭右侧导管,向长颈漏斗中加水,长颈漏斗颈部形成稳定的水柱;
B 先向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,用力拉注射器活塞,长颈漏斗下端冒气泡;
C 先向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,用力推注射器活塞,长颈漏斗中液面上升;
D 将导管浸入水中,双手捂住锥形瓶外壁,观察到导管口没有气泡;
(4)小王选择E、F组合制备氧气,写出该反应的文字表达式________,为了不影响氧气纯度,最佳收集时刻是____________。
(5)如图装置具有多种用途。
①收集气体:如收集二氧化碳气体时,只要将气体从____(填a或b)通入。该装置也可以代替上图中的F装置。请简述操作方法:__________________。
②检验气体:如检验某气体中是否含有二氧化碳,瓶中预先装入_______,然后将气体从_________(填a或b)通入,写出该反应的文字表达式_______
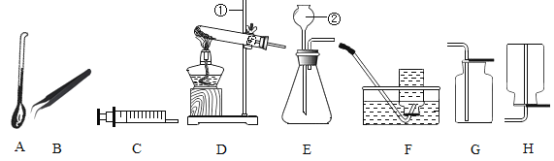
(6)下图也是实验室制取气体时常用的发生装置。其中装置②上的注射器的作用与装置①上______(写仪器名称)作用类似,能做到“随开随用,随关随停”的是_____________(填序号),④中使用了小试管,其优点的是___________________________(写一个)。
(7)小明同学探究了影响双氧水分解速度的某种因素,根据他记录在下表中实验数据 可得出的结论是:在相同条件下,________,双氧水分解得越快。
双氧水的质量 | 双氧水的浓度 | 二氧化锰的质量 | 相同时间内产生的氧气的体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
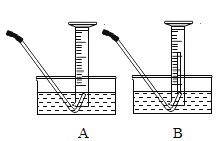
小明用如图所示方法量取氧气体积,读数前需要冷却至室温后,调整量筒使内外液面相平,若仰视读数,则读数_______实际值(填< 、 > 、或= )。则测量O2体积应选下图中的_______________装置更合理(填编号)。
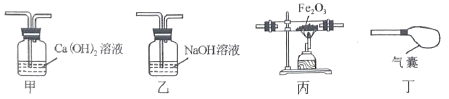
【题目】某学校化学兴趣小组的同学们在实验室发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(提出问题)白色粉末成分的猜想和成因分析。
(做出猜想)①可能是CaCO3:原因是石灰水与空气中的CO2反应。
②可能是___________:原因是溶剂蒸发,石灰水中的溶质结晶析出。
③还可能是Ca(OH)2和CaCO3。
(实验探究)甲同学取白色粉末于试管中,加少量的水、振荡,发现试管底部有白色固体,于是他得出白色粉末是CaCO3的结论。乙同学认为甲同学的结论不严密,理由是______________________。
为了得出较严密的结论,他们进行了下表所示实验,请完成实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中 ___________________ |
②往上述试管残留的白色固体中加入___________ | ___________ | 白色粉末中含有CaCO3 |
由上述实验可知,白色粉末成分的猜想③是正确的。
(拓展反思)通过上述实验的探究,同学们向实验员提出了保存、使用易变质溶液的下列建议,合理的是_________。
a 密封保存 b 使用前临时配制 c 禁止使用该试剂
【题目】2018年1月11日,广西某地高速公路大桥上用于融冰作业的2包共100公斤含有亚硝酸钠的工业盐遗失,当地迅速组织警力开展搜寻遗失的工业盐,确保不流入市场和家庭。
(资料卡1)亚硝酸钠与食盐氯化钠相似,为白色有咸味的固体,但误食会使人中毒。腌制食品、泡菜等制作过程中会产生亚硝酸钠。
根据以上资料,回答下列问题:
(1)用盐融冰的原理是____,该过程主要发生的是___(填“物理变化”或“化学变化”)。
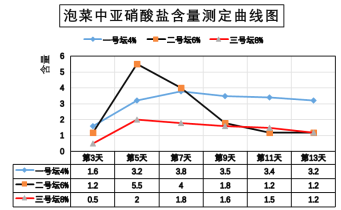
(2)下图是用不同浓度盐水腌制泡菜过程中亚硝酸盐含量测定曲线图。据此回答:当盐水浓度为6%时,第____天亚硝酸盐含量达到最大值。为了安全,泡菜腌制时盐水浓度最好是____并在腌制____天后再食用。
(3)兴趣小组欲测定某工业盐中亚硝酸钠的质量分数
(资料卡2)实验室常用亚硝酸钠与氯化铵溶液反应制取纯净的氮气,其化学方程式为:NaNO2 + NH4Cl ![]() NaCl + N2↑+ 2H2O(此反应是放热反应)
NaCl + N2↑+ 2H2O(此反应是放热反应)
(资料卡3)在酸性环境中高锰酸钾能与亚硝酸钠发生如下反应:2KMnO4 + 5NaNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5NaNO3 + 3H2O
(方案一)取1g该工业盐样品与足量氯化铵溶液于如图装置中充分反应(该工业盐中其他成分不与氯化铵溶液反应),实验时加热片刻后,即可移去酒精灯,其原因___。最终量筒中收集到300mL水,已知该条件下氮气的密度为1.25g/L,则该工业盐样品中亚硝酸钠的质量分数为____(写出计算过程,结果保留一位小数,)。
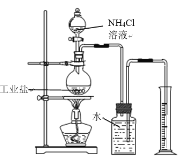
实验结束后发现测量结果偏大,可能原因是____。
(方案二)为更准确地测定该工业盐中亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用含量为15.8g/L的酸性KMnO4溶液进行反应,实验所得数据如下表所示:
实验次序 | 1 | 2 | 3 | 4 |
KMnO4溶液体积(mL) | 20.60 | 20.02 | 20.00 | 19.98 |
上述第____次实验所得数据明显异常,剔除异常数据后,计算出该工业盐中亚硝酸钠的质量分数为___。