题目内容
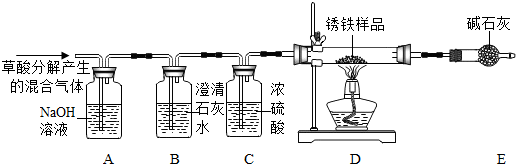
(2012?高新区一模)某化学小组利用下图所示装置来测定生锈铁粉的组成(假设生锈铁粉只含有铁和Fe2O3?xH2O).操作过程如下:
取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置E增重8.4g.若将装置E换成装浓硫酸的洗气瓶F,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置F增重1.8g.
假设每步反应都完全进行并忽略空气对本实验的影响.
已知:
①铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3?xH2O;
②又知草酸(H2C2O4)分解的化学方程式为H2C2O4
CO↑+CO2↑+H2O;
③碱石灰的成份为:氢氧化钠和氧化钙的混合物.
(1)装置B的作用是
(2)理论上x=
(3)该装置还存在的一个缺陷是
取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置E增重8.4g.若将装置E换成装浓硫酸的洗气瓶F,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置F增重1.8g.
假设每步反应都完全进行并忽略空气对本实验的影响.

已知:
①铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3?xH2O;
②又知草酸(H2C2O4)分解的化学方程式为H2C2O4
| 浓硫酸 | 加热 |
③碱石灰的成份为:氢氧化钠和氧化钙的混合物.
(1)装置B的作用是
检验草酸产生的二氧化碳是否除尽
检验草酸产生的二氧化碳是否除尽
.(2)理论上x=
2
2
;若没有装置C,则x的值将偏大
偏大
(选填“偏大”或“偏小”或“不变”);样品中铁单质和Fe2O3?xH2O的质量比为2:7
2:7
.(3)该装置还存在的一个缺陷是
缺少尾气处理装置
缺少尾气处理装置
.分析:(1)根据二氧化碳能使澄清石灰水变浑浊这一现象来检验二氧化碳是否被除尽;
(2)根据浓硫酸吸收水和碱石灰吸收水和二氧化碳,求出二氧化碳的质量,然后根据二氧化碳求出氧化铁的质量,从而求出x的值;
(3)一氧化碳有毒,不能排放到空气中,所以应该有尾气处理装置.
(2)根据浓硫酸吸收水和碱石灰吸收水和二氧化碳,求出二氧化碳的质量,然后根据二氧化碳求出氧化铁的质量,从而求出x的值;
(3)一氧化碳有毒,不能排放到空气中,所以应该有尾气处理装置.
解答:解:(1)二氧化碳能使澄清石灰水变浑浊,装置B的作用是:检验草酸产生的二氧化碳是否除尽;
(2)浓硫酸吸收水,碱石灰吸收水和二氧化碳.取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置E增重8.4g.若将装置E换成装浓硫酸的洗气瓶F,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置F增重1.8g.所以水的质量为1.8g,二氧化碳的质量为8.4g-1.8g=6.6g,设氧化铁的质量为y,
Fe2O3+3CO
2Fe+3CO2
160 132
y 6.6g
=
y=8g
则氧化铁和水的分子个数比=
:
=1:2,所以x=2.
如果草酸中的水没有除去,则后面水的质量增加,所以会导致x的值将偏大.
样品中铁的质量为=12.6g-(8g+1.8g)=2.8g,所以样品中铁单质和Fe2O3?xH2O的质量比=2.8g:(8g+1.8g)=2:7;
(3)一氧化碳有毒,不能排放到空气中,所以应该有尾气处理装置.
故答案为:(1)检验草酸产生的二氧化碳是否除尽;
(2)2;偏大;2:7;
(3)缺少尾气处理装置.
(2)浓硫酸吸收水,碱石灰吸收水和二氧化碳.取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置E增重8.4g.若将装置E换成装浓硫酸的洗气瓶F,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置F增重1.8g.所以水的质量为1.8g,二氧化碳的质量为8.4g-1.8g=6.6g,设氧化铁的质量为y,
Fe2O3+3CO
| ||
160 132
y 6.6g
| 160 |
| y |
| 132 |
| 6.6g |
y=8g
则氧化铁和水的分子个数比=
| 8g |
| 160 |
| 1.8g |
| 18 |
如果草酸中的水没有除去,则后面水的质量增加,所以会导致x的值将偏大.
样品中铁的质量为=12.6g-(8g+1.8g)=2.8g,所以样品中铁单质和Fe2O3?xH2O的质量比=2.8g:(8g+1.8g)=2:7;
(3)一氧化碳有毒,不能排放到空气中,所以应该有尾气处理装置.
故答案为:(1)检验草酸产生的二氧化碳是否除尽;
(2)2;偏大;2:7;
(3)缺少尾气处理装置.
点评:解答本题要掌握铁锈的成分以及化学方程式的计算的方法,要充分理解探究实验的设计方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
