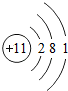
题目内容
(2012?永州)某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
(1)a g铜锌合金中锌的质量为
(a-c)
(a-c)
g(用代数式表示).(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
分析:测定铜锌合金中锌、铜的质量分数,可以依据锌能与稀硫酸反应生成氢气而铜不可以来进行解答.
解答:解:(1)剩余固体的质量就是铜的质量,所以ag铜锌合金中锌的质量为(a-c)g;
(2)锌能与稀硫酸反应生成氢气,所以利用化学方程式可知
Zn+H2SO4═ZnSO4+H2↑
65 2
(a-c)g bg
=
b=
所以a、b、c三者之间的等量关系b=
.
故答案为:(1)(a-c);(2)b=
.
(2)锌能与稀硫酸反应生成氢气,所以利用化学方程式可知
Zn+H2SO4═ZnSO4+H2↑
65 2
(a-c)g bg
| 65 |
| (a-c)g |
| 2 |
| bg |
b=
| 2(a-c) |
| 65 |
所以a、b、c三者之间的等量关系b=
| 2(a-c) |
| 65 |
故答案为:(1)(a-c);(2)b=
| 2(a-c) |
| 65 |
点评:本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目

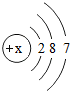 (2012?永州模拟)某元素的原子结构示意图如图所示:
(2012?永州模拟)某元素的原子结构示意图如图所示: B.
B.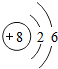 C.
C.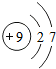 D.
D.