题目内容
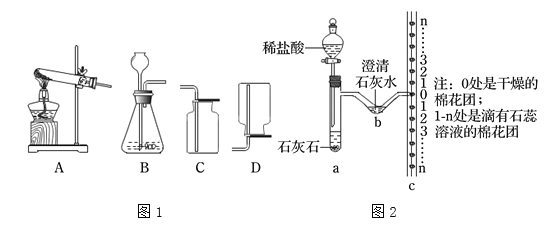
【题目】同学们应用数字化实验探究外界条件对双氧水分解速率的影响.实验装置如图:
【进行实验】
序号 | 主要实验步骤 | 装置内压强-时间图象 |
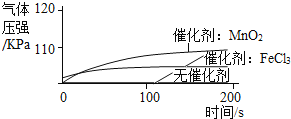
实 验 1 | ①1号抽滤瓶中不加任何试剂, 2号抽滤瓶中加入0.2gMnO2粉末, 3号抽滤瓶中加入0.2gFeCl3粉末. ②用三支分液漏斗分别加入15mL4%的H2O2溶液. |
|
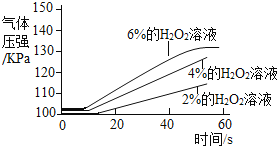
实 验 2 | ①三个抽滤瓶中分别加入0.2gFeCl3粉末. ②分别用1号分液漏斗加入15mL2%的H2O2溶液;用2号分液漏斗加入15mL4%的H2O2溶液;用3号分液漏斗加入15mL6%的H2O2溶液. |
|
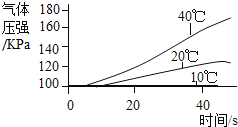
实 验 3 | ①三个抽滤瓶中分别加入0.2gFeCl3粉末,分别放入装有10℃、20℃、40℃水的水槽中. ②用三支分液漏斗分别加入15mL4%的H2O2溶液. |
|
【解释与结论】
(1)实验1的2号抽滤瓶中反应的化学方程式为 ______ .
(2)某同学得到“不同催化剂的催化效果不同”的结论,他的依据是 ______ .
(3)通过上述实验得到:影响该反应速率的外界因素有 ______ .
【反思与评价】
(4)经过多次实验,有的同学对比实验1的3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是 ______ .
【答案】 2H2O2 ![]() 2H2O+O2↑ 实验1中2、3号瓶曲线不同 催化剂种类、反应物浓度、温度 实验温度不同
2H2O+O2↑ 实验1中2、3号瓶曲线不同 催化剂种类、反应物浓度、温度 实验温度不同
【解析】(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式表示为:2H2O2 ![]() 2H2O+O2↑;(2)由实验1中的2、3号抽滤瓶中加入0.2gMnO2粉末和0.2gFeCl3粉末后的曲线可知,不同的催化剂催化效果不同;(3)实验1通过比较的相同的过氧化氢溶液中加入不同的催化剂,得出催化剂不同,过氧化氢反应速率不同;实验2通过比较使用相同的催化剂,不同浓度的过氧化氢溶液可知,过氧化氢溶液的浓度越大,反应速率越快;实验3通过比较使用相同的催化剂、相同浓度的过氧化氢溶液、不同的温度下的反应可知:温度越高,反应速率越快。通过这3个实验得到:影响该反应速率的外界因素有催化剂种类、反应物浓度、温度;(4)在过氧化氢的浓度、催化剂的种类相同的条件下,温度不同,化学反应速率不同。故实验1的3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是实验时的温度不同。
2H2O+O2↑;(2)由实验1中的2、3号抽滤瓶中加入0.2gMnO2粉末和0.2gFeCl3粉末后的曲线可知,不同的催化剂催化效果不同;(3)实验1通过比较的相同的过氧化氢溶液中加入不同的催化剂,得出催化剂不同,过氧化氢反应速率不同;实验2通过比较使用相同的催化剂,不同浓度的过氧化氢溶液可知,过氧化氢溶液的浓度越大,反应速率越快;实验3通过比较使用相同的催化剂、相同浓度的过氧化氢溶液、不同的温度下的反应可知:温度越高,反应速率越快。通过这3个实验得到:影响该反应速率的外界因素有催化剂种类、反应物浓度、温度;(4)在过氧化氢的浓度、催化剂的种类相同的条件下,温度不同,化学反应速率不同。故实验1的3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是实验时的温度不同。
点睛:验证某条件的影响要采用控制变量法。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】以下4个图象,能正确反映对应关系的是( )
A | B | C | D |
利用红磷燃烧测定空气中氧气的含量(打开止水夹前) | 加热一定质量高锰酸钾固体 | 木炭在盛有氧气的密闭容器内燃烧 | 甲醛和过量的氧气在密闭容器中完全反应 |
|
|
|
|
A. A B. B C. C D. D