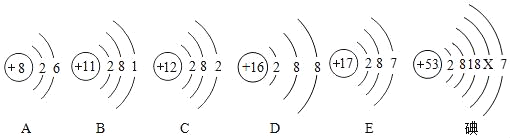
题目内容
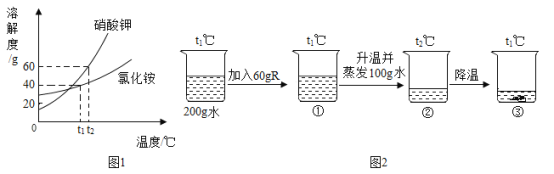
【题目】Na2SO3在印染、造纸等行业中有着广泛的应用。某研究小组采用图1所示流程制备Na2SO3。
[查阅资料]反应Ⅰ中随着SO2的增加,依次发生如下化学反应:
①SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3;
②SO2+2NaHCO3=Na2SO3+2CO2↑+H2O;
③SO2+H2O+Na2SO3=2NaHSO3。
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为_____。
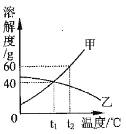
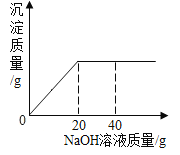
(2)操作1采用蒸发结晶的方法分离混合溶液得到Na2SO3晶体。由此可知,Na2SO3的溶液曲线与下图2中_____(填“A”或“B”)物质的溶解度曲线相似。
(3)操作2中使用玻璃棒的作用是_____。
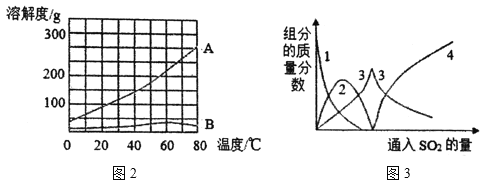
(4)反应Ⅰ通入SO2后,溶液中有关组分的质量分数变化如上图3所示。图中曲线3表示Na2SO3的质量分数变化情况,则曲线1表示_____(填化学式,下同)的质量分数的变化情况,曲线2表示_____的质量分数的变化情况。
(5)反应Ⅱ加入NaOH溶液的目的是将反应Ⅰ生成的NaHSO3转化为Na2SO3,该化学反应方程式为_____。
【答案】亚硫酸钠 B 引流 Na2CO3 NaHCO3 NaOH+NaHSO3=H2O+Na2SO3
【解析】
(1)由于H2SO3的名称为亚硫酸,所以Na2SO3的是亚硫酸对应的钠盐,所以名称为亚硫酸钠;
(2)常用蒸发结晶的方法分离混合溶液得到Na2SO3,说明亚硫酸钠的溶解度随温度变化不大,所以Na2SO3的溶解度曲线是与图2中的 B物质的溶解度曲线相似;
(3)操作2是将固体和液体进行分离的过滤操作,使用玻璃棒的作用是引流;
(4)向碳酸钠溶液通入二氧化硫的过程中,碳酸钠应该越来越少,所以线1表示 Na2CO3的质量分数的变化情况,而线2表示 NaHCO3的质量分数的变化情况,最终亚硫酸钠转化为亚硫酸氢钠,所以线4是亚硫酸氢钠;
(5)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的NaHSO3转化为Na2SO3,是氢氧化钠和亚硫酸氢钠反应生成亚硫酸钠和水,对应的化学反应方程式为 NaOH+NaHSO3=H2O+Na2SO3。

【题目】某学习小组对用碳酸盐可以制取CO2进行如下研究:
(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
①从表中数据获得信息_____.
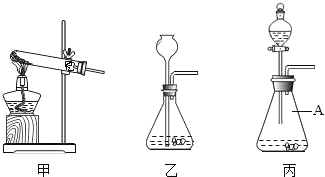
②如图是一组实验装置,该实验除用到电子秤外,还需用图中_____装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为_____,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是_____.
④请写出块状碳酸钙固体与稀盐酸反应方程式为_____.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需_____(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?_____,因为:_____.
A 块状石灰石与稀盐酸 B 块状石灰石与稀硫酸
C 块状纯碱晶体与稀盐酸 D 块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为_____,用装置甲制取氧气的化学反应方程式为_____.