题目内容
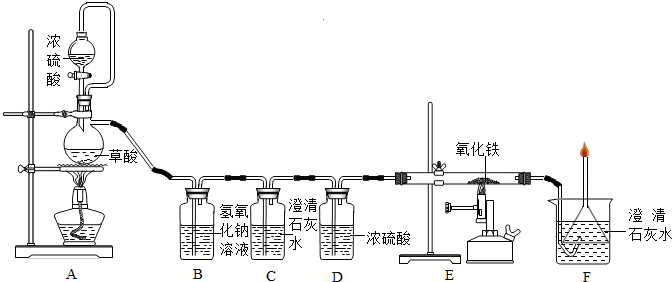
钢铁是使用最多的金属材料.在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了有关铁的实验.用干燥纯净的一氧化碳还原赤铁矿中的氧化铁,并求出赤铁矿中氧化铁的质量分数.实验装置如下图:

其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:H2C2O4 H2O+CO2↑+CO↑.请回答下列问题:
H2O+CO2↑+CO↑.请回答下列问题:
(1)B装置中发生反应的化学方程式是______.
(2)C装置无明显现象,C装置的作用是______.D装置中浓硫酸的作用是______.
(3)E装置中赤铁矿样品的质量为5g,完全反应后剩余固体质量为3.8g,则赤铁矿中氧化铁的质量分数为______.
(4)F装置的作用是______.
解:(1)B中的溶液是氢氧化钠,能与二氧化碳反应生成碳酸钠和水,用于除去二氧化碳,其方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)C中无明显现象说明气体通过B后已无二氧化碳气体的存在,从而起到检验草酸生成的混合气体中二氧化碳是否除尽的作用;
D中浓硫酸具有吸水性,用于吸水干燥以得到干燥的一氧化碳;
(3)由题意可知道,反应前后固体的质量之差为5克-3.8克=1.2g,这减少的质量就是三氧化二铁被CO还原后失去的氧的质量.
在Fe2O3中氧的质量分数为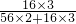 ×100%=30%,由氧的质量可求得Fe2O3的质量1.2克÷30%=4g,所以赤铁矿石中氧化铁的质量分数为
×100%=30%,由氧的质量可求得Fe2O3的质量1.2克÷30%=4g,所以赤铁矿石中氧化铁的质量分数为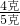 ×100%=80%;
×100%=80%;
(4)澄清石灰水能检验E装置反应产物中是否含有二氧化碳,收集燃烧则是处理掉多余的一氧化碳,以防有毒的一氧化碳污染空气;
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)检验草酸生成的混合气体中二氧化碳是否被除尽;吸水干燥;
(3)80%;
(4)检验一氧化碳与氧化铁反应后有二氧化碳气体生成;利用燃烧法处理多余的一氧化碳气体,防止空气污染.
分析:(1)依据该装置的作用是除去二氧化碳,书写出正确的方程式;
(2)依据澄清石灰水能检验二氧化碳的存在分析判断;浓硫酸的吸水性分析;
(3)根据质量分数的定义推算;
(4)从F装置中的溶液成分以及对尾气的处理分析即可;
点评:本题考查一氧化碳还原氧化铁的实验装置及相关问题,属于课本基本实验的延伸,难度不大,要明确实验的目的及试剂的作用.
(2)C中无明显现象说明气体通过B后已无二氧化碳气体的存在,从而起到检验草酸生成的混合气体中二氧化碳是否除尽的作用;
D中浓硫酸具有吸水性,用于吸水干燥以得到干燥的一氧化碳;
(3)由题意可知道,反应前后固体的质量之差为5克-3.8克=1.2g,这减少的质量就是三氧化二铁被CO还原后失去的氧的质量.
在Fe2O3中氧的质量分数为
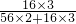 ×100%=30%,由氧的质量可求得Fe2O3的质量1.2克÷30%=4g,所以赤铁矿石中氧化铁的质量分数为
×100%=30%,由氧的质量可求得Fe2O3的质量1.2克÷30%=4g,所以赤铁矿石中氧化铁的质量分数为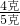 ×100%=80%;
×100%=80%;(4)澄清石灰水能检验E装置反应产物中是否含有二氧化碳,收集燃烧则是处理掉多余的一氧化碳,以防有毒的一氧化碳污染空气;
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)检验草酸生成的混合气体中二氧化碳是否被除尽;吸水干燥;
(3)80%;
(4)检验一氧化碳与氧化铁反应后有二氧化碳气体生成;利用燃烧法处理多余的一氧化碳气体,防止空气污染.
分析:(1)依据该装置的作用是除去二氧化碳,书写出正确的方程式;
(2)依据澄清石灰水能检验二氧化碳的存在分析判断;浓硫酸的吸水性分析;
(3)根据质量分数的定义推算;
(4)从F装置中的溶液成分以及对尾气的处理分析即可;
点评:本题考查一氧化碳还原氧化铁的实验装置及相关问题,属于课本基本实验的延伸,难度不大,要明确实验的目的及试剂的作用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 钢铁是使用最多的金属材料.
钢铁是使用最多的金属材料.