题目内容
某化工厂排出的不含钙废水澄清透明、略显蓝色.某同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成.过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀.
(1)加入过量的盐酸,生成的白色沉淀是________(填化学式,下同);滤液中加入稀硫酸,生成的白色沉淀是________.
(2)在下列物质中,废水中含有的是________(选填序号)
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
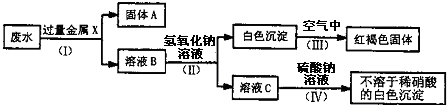
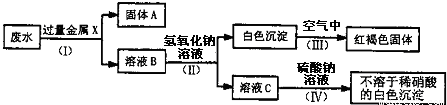
(3)该同学设计了一个从废水中除去重金属离子的实验方案(如下图所示).[已知:白色的Fe(OH)2固体在潮湿的空气中可迅速转变成红褐色的Fe(OH)3;金属钡比金属钙活泼.]

①固体A中含有的物质是________.
②在下列物质中,溶液B中含有的是________(选填序号).
A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
③第Ⅳ步反应的化学方程式为________.
解:(1)加入盐酸能产生白色不溶于稀硝酸的沉淀是氯化银,加入硫酸能产生不溶于稀硝酸的沉淀是硫酸钡,故填:AgCl,BaSO4;
(2)溶液中含有银离子和钡离子,只能是含有硝酸盐,故填:C;
(3)废水中含有的重金属离子是钡离子、铜离子和银离子,可以加入铁,使铁与硝酸铜和硝酸银反应生成铜和银,故A中含有铁、铜、银,溶液B中含有硝酸亚铁和硝酸钡,硝酸钡能与硫酸钠反应生成硫酸钡和硝酸钠,故答案为:①铁、铜、银;②C D;③Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3.
分析:根据已有的知识进行分析,加入盐酸能产生白色不溶于稀硝酸的沉淀是氯化银,加入硫酸能产生不溶于稀硝酸的沉淀是硫酸钡,说明溶液中含有银离子和钡离子,要除去重金属离子,可以依据金属活动性顺序,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
点评:本题考查了常见物质的性质,完成此题,可以依据物质的性质进行.
(2)溶液中含有银离子和钡离子,只能是含有硝酸盐,故填:C;
(3)废水中含有的重金属离子是钡离子、铜离子和银离子,可以加入铁,使铁与硝酸铜和硝酸银反应生成铜和银,故A中含有铁、铜、银,溶液B中含有硝酸亚铁和硝酸钡,硝酸钡能与硫酸钠反应生成硫酸钡和硝酸钠,故答案为:①铁、铜、银;②C D;③Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3.
分析:根据已有的知识进行分析,加入盐酸能产生白色不溶于稀硝酸的沉淀是氯化银,加入硫酸能产生不溶于稀硝酸的沉淀是硫酸钡,说明溶液中含有银离子和钡离子,要除去重金属离子,可以依据金属活动性顺序,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
点评:本题考查了常见物质的性质,完成此题,可以依据物质的性质进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目