题目内容
2.向锌和碳酸钙的混合固体10g中,加入过量的稀盐酸,将产生气体通过足量的澄清石灰水,澄清石灰水的质量增加3.3g.求:(1)混合气体中二氧化碳的质量为多少?
(2)混合固体中锌的质量分数.
分析 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能与石灰水反应生成碳酸钙沉淀和水,将产生气体通过足量的澄清石灰水,澄清石灰水的质量增加3.3g,即为生成二氧化碳的质量,由二氧化碳的质量,由反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出混合固体中锌的质量分数.
解答 解:(1)澄清石灰水增加的质量,即为混合气体中二氧化碳的质量,故混合气体中二氧化碳的质量为3.3g.
(2)设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{44}=\frac{x}{3.3g}$ x=7.5g
混合固体中锌的质量分数为$\frac{10g-7.5g}{10g}$×100%=25%.
答:(1)混合气体中二氧化碳的质量为3.3g;
(2)混合固体中锌的质量分数为25%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
13.下列化学方程式书写正确,且属于化合反应的是( )
| A. | 2H2O $\stackrel{通电}{→}$H2↑+O2↑ | B. | Ca(OH)2+CO2→CaCO3↓+H2O | ||
| C. | CuSO4+H2O→CuSO4•5 H2O | D. | 4P+5O2$\stackrel{点燃}{→}$2P2O5 |
2.下列实验操作正确的是( )
| A. | 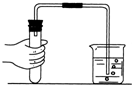 检验仪器气密性 检验仪器气密性 | B. | 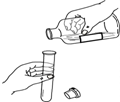 倾倒液体 | C. | 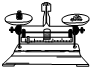 称量固体质量 | D. |  给液体加热 |
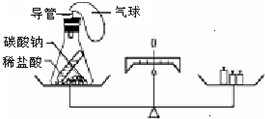 某同学用图装置探究质量守恒定律.
某同学用图装置探究质量守恒定律.