题目内容
某密闭容器中有W、氧气、二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,根据表中信息,判断下列说法正确的是( )
| 物质 | W | O2 | CO2 | H2O |
| 反应前质量/g | 16 | 72 | 2 | 0 |
| 反应后质量/g | 0 | 待测 | 46 | 36 |
A.待测数值为6g
B.W一定不是氧化物
C.CO2是反应物,H2O是生成物
D.反应中CO2和H2O质量变化之比为23:18
B
解析试题分析:A、根据质量守恒定律可以知道,“待测”=16+72+2+0﹣0﹣46﹣36=8,故说法错误;B、根据反应前后质量的变化可以判断二氧化碳和水为生成物,而W和氧气为反应物,根据反应前后元素的种类不变可以知道,在W中含有碳元素和氢元素,又参加反应的44g二氧化碳中碳元素的质量44g×(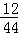 ×100%)=12g,参加反应的36g水中氢元素的质量36g×(
×100%)=12g,参加反应的36g水中氢元素的质量36g×(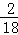 ×100%)=4g,12g+4g=16g,和参加反应的W的质量相等,因此W中只含有碳、氢两种元素,一定不是氧化物,故说法正确;C、根据二氧化碳和水的质量反应后增加可知两者都是生成物,故说法错误;D、反应中生成二氧化碳的质量为:46g﹣2g=44g,生成水的质量为36g,其质量比为44g:36g=22:18,故说法错误
×100%)=4g,12g+4g=16g,和参加反应的W的质量相等,因此W中只含有碳、氢两种元素,一定不是氧化物,故说法正确;C、根据二氧化碳和水的质量反应后增加可知两者都是生成物,故说法错误;D、反应中生成二氧化碳的质量为:46g﹣2g=44g,生成水的质量为36g,其质量比为44g:36g=22:18,故说法错误
考点:质量守恒定律及其应用..

 一本好题口算题卡系列答案
一本好题口算题卡系列答案葡萄酒中含有的白藜芦醇具有美容养颜之功效。下列关于白藜芦醇(C14H12O3)的说法不正确的是
| A.白藜芦醇由碳、氢、氧三种元素组成 |
| B.白藜芦醇的相对分子质量为228 |
| C.白藜芦醇中碳、氢、氧三种元素的个数比为14︰12︰3 |
| D.白藜芦醇中碳、氢、氧三种元素的质量比为14︰1︰4 |
下列关于化学反应xA+yB=mC+nD(x,y,m,n为化学计量数)的说法中,一定正确的是( )
| A.x+y=m+n |
| B.若生成物中有水,该反应是中和反应 |
| C.参加反应的A和B的质量比等于生成物C和D的质量比 |
| D.若A和B的质量均为ag,充分反应后生成物的总质量小于或等于2ag. |
氯气是一种有毒的气体,实验室制取氯气时,可用氢氧化钠溶液来吸收尾气,其反应原理为Cl2+2NaOH=X+NaClO+H2O,则X 的化学式及NaClO中氯元素的化合价分别为( )
| A.NaCl,+1 | B.H2,+3 | C.HCl,+1 | D.NaCl,﹣1 |
豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指( )
| A.原子 | B.分子 | C.元素 | D.单质 |
据报道,药物扎那米韦(化学式为C12H20N4O7)对人感染H7N9禽流感病毒治疗有效.下列有关扎那米韦的说法不正确的是
| A.扎那米韦属于有机高分子化合物 |
| B.1个扎那米韦分子由12个碳原子、20个氢原子、4个氮原子和7个氧原子构成 |
| C.扎那米韦中碳元素、氢元素和氮元素的质量比为3:5:1 |
| D.扎那米韦的相对分子质量为332 |
高铁酸钠(Na2FeO4)被广泛应用于自来水净化,它集吸附、凝聚、杀菌等功能于一体.高铁酸钠中铁元素的化合价为( )
| A.﹣6 | B.+2 | C.+3 | D.+6 |
聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到白色沉淀BaSO44.66g.另一份溶液,加入足量的NaOH溶液后过滤对滤出固体洗涤,后灼烧得到红棕色固体Fe2O3质量为1.6g,该聚合硫酸铁样品中a:b的比值是(已知:BaSO4的相对原子质量为233,Fe2O3相对原子质量为160)
| A.1:1 | B.2:1 | C.3:1 | D.2:5 |
“问题胶囊”已成为公众关注的热点,胶囊中铬含量超标对人体有害.请计算重铬酸钾(K2Cr2O7)中铬元素的化合价.( )
| A.+3 | B.+6 | C.+7 | D.+12 |