题目内容
下列为实验室常用的实验装置,回答下列问题:
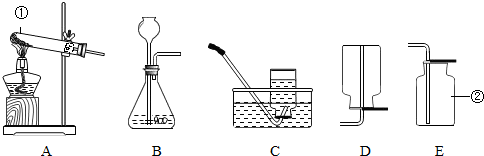
(1)写出带有标号的仪器名称:①
(2)用锌和稀硫酸制取氢气,应选用的发生装置是
(3)实验室用稀盐酸和石灰石反应制CO2,该反应的化学方程式

(1)写出带有标号的仪器名称:①
试管
试管
; ②集气瓶
集气瓶
.(2)用锌和稀硫酸制取氢气,应选用的发生装置是
B
B
(填序号,下同)收集装置是C或D
C或D
.(3)实验室用稀盐酸和石灰石反应制CO2,该反应的化学方程式
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;此外也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式2NaHCO3
H2O+CO2↑+Na2CO3
| ||
2NaHCO3
H2O+CO2↑+Na2CO3
,若用此法来制取CO2应选用的发生装置为
| ||
A
A
,收集装置为E
E
.分析:(1)依据常用仪器回答;
(2)根据反应物状态和反应条件选择发生装置,据气体的密度和溶解性选择收集装置;
(3)依据稀盐酸和石灰石反应原理书写方程式;并据加热碳酸氢钠的反应原理书写方程式,据发生和收集装置的选择方法分析解答.
(2)根据反应物状态和反应条件选择发生装置,据气体的密度和溶解性选择收集装置;
(3)依据稀盐酸和石灰石反应原理书写方程式;并据加热碳酸氢钠的反应原理书写方程式,据发生和收集装置的选择方法分析解答.
解答:解:(1)标号仪器分别是试管和集气瓶;
(2)用锌和稀硫酸制取氢气,不需加热,属于固液常温型,故选B发生装置;氢气的密度比空气大且难溶于水,故可用向下排空气或排水法收集;
(3)稀盐酸和石灰石反应生成二氧化碳、水和氯化钙,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;加热碳酸氢钠(NaHCO3)固体生成碳酸钠、二氧化碳、水,反应方程式为:2NaHCO3
H2O+CO2↑+Na2CO3;该反应需要加热,属于固体加热型,故选发生装置A,二氧化碳的密度比空气大且能溶于水,故只能用向上排空气法收集;
故答案为:(1)试管;集气瓶;
(2)B;C;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;2NaHCO3
H2O+CO2↑+Na2CO3;A;E.
(2)用锌和稀硫酸制取氢气,不需加热,属于固液常温型,故选B发生装置;氢气的密度比空气大且难溶于水,故可用向下排空气或排水法收集;
(3)稀盐酸和石灰石反应生成二氧化碳、水和氯化钙,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;加热碳酸氢钠(NaHCO3)固体生成碳酸钠、二氧化碳、水,反应方程式为:2NaHCO3
| ||
故答案为:(1)试管;集气瓶;
(2)B;C;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;2NaHCO3
| ||
点评:掌握装置选取方法、方程式的书写及常用仪器,即可顺利解答此题.

练习册系列答案
相关题目
氢氧化钠是化学实验室中的常用试剂,盛放NaOH溶液的试剂瓶瓶口常会出现白色粉末.化学兴趣小组的同学对这种白色粉末进行了实验探究.
他们依据所学的化学知识,对这种白色粉末的成分作了如下三种不同的猜想:
【提出猜想】
①甲同学认为可能是NaOH;
②乙同学认为可能是 ________;
③丙同学认为可能是NaOH和Na2CO3的混合物.
请将乙同学的猜想填写完整.为了验证猜想,他们进行了下面的实验:
【实验探究】
(1)甲同学取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,溶液变成红色.由此该同学认为白色粉末是NaOH.请判断他所得出的结论是否正确,并简述理由:________.
(2)乙同学为验证他的猜想,设计了下列实验,请将下列实验报告填写完整.
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| 取少量白色粉末 滴加稀盐酸 | 有 ________生成 | 乙同学认为自己的猜想正确. 反应的方程式为: ________ |
(3)丙同学认为乙同学得出的结论不严密.为验证自己的猜想,该同学取少量白色粉末溶于水,向所得的溶液中滴加过量的BaCl2溶液,有白色沉淀产生,由此判断白色粉末中含有 ________;该同学继续向溶液中滴加 ________,证明了自己的猜想正确.
【问题讨论】如果实验室中没有BaCl2溶液,能否用Ba(OH)2溶液代替,并说明理由:________.
氢氧化钠是化学实验室中的常用试剂,盛放NaOH溶液的试剂瓶瓶口常会出现白色粉末.化学兴趣小组的同学对这种白色粉末进行了实验探究.
他们依据所学的化学知识,对这种白色粉末的成分作了如下三种不同的猜想:
【提出猜想】
①甲同学认为可能是NaOH;
②乙同学认为可能是 ;
③丙同学认为可能是NaOH和Na2CO3的混合物.
请将乙同学的猜想填写完整.为了验证猜想,他们进行了下面的实验:
【实验探究】
(1)甲同学取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,溶液变成红色.由此该同学认为白色粉末是NaOH.请判断他所得出的结论是否正确,并简述理由:.
(2)乙同学为验证他的猜想,设计了下列实验,请将下列实验报告填写完整.
(3)丙同学认为乙同学得出的结论不严密.为验证自己的猜想,该同学取少量白色粉末溶于水,向所得的溶液中滴加过量的BaCl2溶液,有白色沉淀产生,由此判断白色粉末中含有 ;该同学继续向溶液中滴加 ,证明了自己的猜想正确.
【问题讨论】如果实验室中没有BaCl2溶液,能否用Ba(OH)2溶液代替,并说明理由:.
他们依据所学的化学知识,对这种白色粉末的成分作了如下三种不同的猜想:
【提出猜想】
①甲同学认为可能是NaOH;
②乙同学认为可能是 ;
③丙同学认为可能是NaOH和Na2CO3的混合物.
请将乙同学的猜想填写完整.为了验证猜想,他们进行了下面的实验:
【实验探究】
(1)甲同学取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,溶液变成红色.由此该同学认为白色粉末是NaOH.请判断他所得出的结论是否正确,并简述理由:.
(2)乙同学为验证他的猜想,设计了下列实验,请将下列实验报告填写完整.
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| 取少量白色粉末 滴加稀盐酸 | 有 生成 | 乙同学认为自己的猜想正确. 反应的方程式为: |
(3)丙同学认为乙同学得出的结论不严密.为验证自己的猜想,该同学取少量白色粉末溶于水,向所得的溶液中滴加过量的BaCl2溶液,有白色沉淀产生,由此判断白色粉末中含有 ;该同学继续向溶液中滴加 ,证明了自己的猜想正确.
【问题讨论】如果实验室中没有BaCl2溶液,能否用Ba(OH)2溶液代替,并说明理由:.
 如图是常用的实 验装置图,根据所学知识回答下列问题:
如图是常用的实 验装置图,根据所学知识回答下列问题: