题目内容
【题目】如图为实验室制取气体的常用装置. 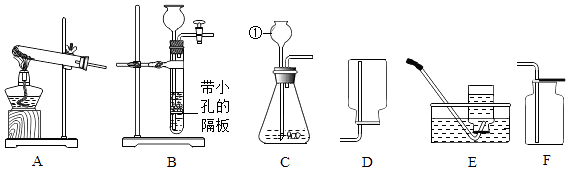
(1)仪器①的名称是 .
(2)以A 为发生装置,用高锰酸钾制取的氧气化学方程式为 , 该装置中有一处错误是 , 收集一瓶较干燥的气体应用 .
(3)B,C 都可以作为制取二氧化碳发生装置,B装置相对C装置的优点是 .
(4)酸的种类、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行了如下五组实验:
药品 | 甲 | 乙 | 丙 | 丁 | 戊 |
大理石(mg) | 块状 | 块状 | 粉末状 | 粉末状 | 块状 |
盐酸(ng) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 | 稀硫酸 |
①大理石与盐酸反应的化学方程式是;
②实验甲与(填编号)对照,是为了研究酸的浓度对反应速率的影响;
③实验戊与(填编号)对照,是为了研究酸的种类对反应速率的影响.
【答案】
(1)长颈漏斗
(2)2KMnO4 ![]() K2MnO4+MnO2+O2↑;试管口没有放棉花团;F
K2MnO4+MnO2+O2↑;试管口没有放棉花团;F
(3)可以控制反应的开始与停止
(4)CaCO3+2HCl═CaCl2+H2O+CO2↑;乙;甲
【解析】解:(1)仪器①是长颈漏斗;故填:长颈漏斗;(2)实验室用高锰酸钾制取氧气的化学方程式为:2KMnO4 ![]() K2MnO4+MnO2+O2↑,因为反应不需要加热,发生装置应该选用A,为了防止高锰酸钾进入导管,试管口应放一团棉花,向上排空气法收集的氧气比较干燥;故填:2KMnO4
K2MnO4+MnO2+O2↑,因为反应不需要加热,发生装置应该选用A,为了防止高锰酸钾进入导管,试管口应放一团棉花,向上排空气法收集的氧气比较干燥;故填:2KMnO4 ![]() K2MnO4+MnO2+O2↑;试管口没有放棉花团;F;(3)与C装置相比,B装置可以控制反应的开始与停止;故填:可以控制反应的开始与停止;(4)①实验室制取二氧化碳是用大理石和稀盐酸反应,大理石的主要成分是碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,其化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;②甲与乙对比,相同质量的块状大理石分别与稀盐酸与浓盐酸反应,根据产生气泡的速率推断出酸的浓度对反应速率的影响;故填:乙;③实验戊与甲对照,相同质量的块状大理石分别与稀盐酸和稀硫酸反应,根据产生气泡的速率推断出酸的种类对反应速率的影响;故填:甲.
K2MnO4+MnO2+O2↑;试管口没有放棉花团;F;(3)与C装置相比,B装置可以控制反应的开始与停止;故填:可以控制反应的开始与停止;(4)①实验室制取二氧化碳是用大理石和稀盐酸反应,大理石的主要成分是碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,其化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;②甲与乙对比,相同质量的块状大理石分别与稀盐酸与浓盐酸反应,根据产生气泡的速率推断出酸的浓度对反应速率的影响;故填:乙;③实验戊与甲对照,相同质量的块状大理石分别与稀盐酸和稀硫酸反应,根据产生气泡的速率推断出酸的种类对反应速率的影响;故填:甲.
【考点精析】掌握氧气的收集方法和书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部;注意:a、配平 b、条件 c、箭号.
