题目内容
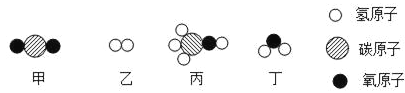
【题目】A~F均为初中化学常见的物质,他们之间的关系如图所示(“→”表示转化关系,所涉及反应均为初中常见的化学反应),其中A是常见的食品干燥剂,其余的五种物质分别是单质、氧化物、酸、碱、盐。
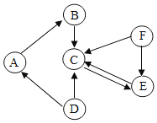
(1)C的化学式是________;
(2)D的一种用途是________;
(3)A→B反应的基本类型是________;
(4)F→E反应的化学方程式为____________。
【答案】H2O 做补钙剂 化合反应 Fe+2HCl=FeCl2+H2![]() (合理即可)
(合理即可)
【解析】
A~F均为初中化学常见的物质,A是常见的食品干燥剂,所以A是氧化钙,碳酸钙在高温条件下分解成二氧化碳和氧化钙,故D是碳酸钙,为盐;氧化钙与水反应会转化成B,所以B是氢氧化钙,为碱;C是单质、氧化物、酸中的一种,且氢氧化钙和碳酸钙都能经过反应生成C,氢氧化钙和酸反应可以生成水,碳酸钙和酸反应也可以生成水,所以C是水,为氧化物;F会转化成C和E,C、E可以相互转化,且E、F为单质或酸中的一种,故F为盐酸或硫酸,可以与碱或金属氧化物反应生成水,可以与金属反应生成氢气,氢气是单质,氢气在氧气中燃烧生成水、水在通电条件下生成氢气和氧气,故E为氢气,经过验证,推导正确。
(1)经过分析可知,C是H2O;
(2)D是碳酸钙,可以做补钙剂;
(3)A→B的反应是氧化钙和水反应生成氢氧化钙,基本类型是化合反应;
(4)F→E的反应是盐酸或硫酸与金属反应生成氢气,反应方程式为:Fe+2HCl=FeCl2+H2![]() (合理即可)。
(合理即可)。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
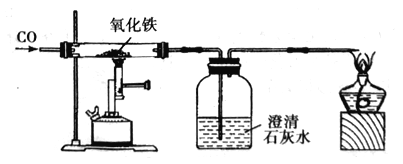
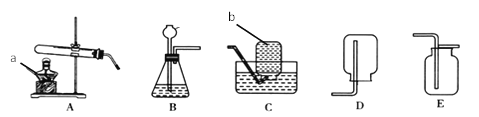
黄冈课堂作业本系列答案【题目】某校化学实验小组的同学们对影响化学反应速率的因素产生了兴趣,为了探究氧化铁能否加快过氧化氢的分解,他们设计了实验装置,并进行气体的制备和测量实验。实验时均以生成40mL气体为标准,相关实验数据记录如表:
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/mL | 过氧化氢溶液温度/℃ | 氧化铁的用量/g | 收集40mL氧气所需时间/s |
① | 5 | 10 | 20 | 0 | 128.5 |
② | 5 | 10 | 20 | 1.2 | 16.8 |
③ | 15 | 10 | 20 | 1.2 | 10.5 |
④ | 5 | 10 | 70 | 0 | 32.7 |
(1)若要证明氧化铁是过氧化氢分解的催化剂,还需要验证它在该反应前后质量和_____未发生改变。请写出过氧化氢在氧化铁的催化下反应的文字表达式:_____,该反应属_____反应(填基本反应类型)
(2)完成上述实验及数据的测定需要用到如图1中的部分装置,请按组装顺序写出所用到的装置代号_____。

(3)用一定量10%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总量_____(选填“减小”“不变”或“增大”)。
(4)通过实验①和④对比可知,温度越高化学反应速率越快,同理通过实验②和③对比可知,得出结论是_____。
查阅资料:将新制的溶质质量分数为5%的过氧化氢溶液,加热到80℃时,才有较多氧气产生,而相同质量5%的过氧化氢溶液加入催化剂,常温下就会立即产生氧气。
(5)采用相同质量5%的过氧化氢溶液,图G虚线表示加热分解制取氧气的曲线,请你在该图2中用实线画出利用催化剂制取氧气的大致曲线(假定两种方法过氧化氢均完全分解)。_________
(6)同学们还想探究催化剂的颗粒大小对化学反应速率是否有影响,请你帮他们设计实验方案进行探究。___________