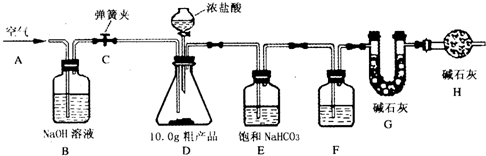
题目内容
3、浓盐酸是
氯化氢
的水溶液,为无色
色,有刺激性
气味的液体,易挥发
,所以如果敞口放置在空气中会形成白雾
,同时溶液的溶质的质量分数
减小.工业盐酸因含有杂质而呈黄
色.分析:氯化氢气体易溶于水;
浓盐酸具有挥发性,在空气中敞口放置会形成白雾;
溶质的质量分数即溶质的质量与溶液的质量之比.
浓盐酸具有挥发性,在空气中敞口放置会形成白雾;
溶质的质量分数即溶质的质量与溶液的质量之比.
解答:解:浓盐酸具有挥发性,在空气中能挥发出氯化氢气体,氯化氢气体与空气中的水蒸气结合,形成了盐酸的小液滴--白雾.同时,由于溶质的质量减小,所以溶液中溶质的质量分数也会减小.
故答案为:氯化氢;无色;刺激性;挥发;白雾;溶质的质量分数;黄.
故答案为:氯化氢;无色;刺激性;挥发;白雾;溶质的质量分数;黄.
点评:浓盐酸具有挥发性,在在空气中敞口放置会形成白雾.注意雾和烟不同:雾是液体小滴,而烟是固体小颗粒.

练习册系列答案
相关题目



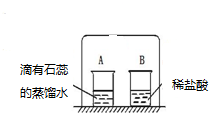
 在小烧杯A中加入20mL蒸馏水,滴入2~3滴紫色石蕊试液,得到的溶液呈紫色.在小烧杯B中加入20mL浓盐酸(盐酸是氯化氢气体溶于水形成的溶液);用一只大烧杯把A、B两个烧杯罩在一起(如图所示).过几分钟,看到烧杯A中的溶液变成红色.
在小烧杯A中加入20mL蒸馏水,滴入2~3滴紫色石蕊试液,得到的溶液呈紫色.在小烧杯B中加入20mL浓盐酸(盐酸是氯化氢气体溶于水形成的溶液);用一只大烧杯把A、B两个烧杯罩在一起(如图所示).过几分钟,看到烧杯A中的溶液变成红色.