题目内容
某化学课外活动小组进行了一系列的实验,请按要求作答:
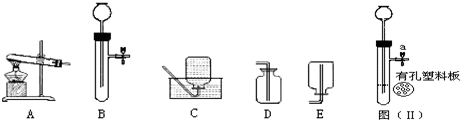
(1)林同学用A装置制氧气的化学方程式是
(2)小松同学使用图(Ⅱ)装置制取CO2,现有①Na2CO3固体;②块状大理石;③稀HCl;④稀H2SO4四种试剂,应选用的试剂是
(3)小明通过查阅资料得知,增大蔬菜大棚里空气中的CO2浓度,可以有效地提高蔬菜的产量.他计划用稀盐酸和石灰石(主要成分是CaCO3,杂质不参与反应)反应,向自家的蔬菜大棚补充CO2.经测算,小明准备向大棚中输入88gCO2,他至少需要10%的稀盐酸多少克?

(1)林同学用A装置制氧气的化学方程式是
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
,用
| ||
| △ |
排水法(或向上排空气法)
排水法(或向上排空气法)
法收集氧气.反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,黑色粉末在反应中的作用是
| ||
催化作用
催化作用
.(2)小松同学使用图(Ⅱ)装置制取CO2,现有①Na2CO3固体;②块状大理石;③稀HCl;④稀H2SO4四种试剂,应选用的试剂是
②③
②③
(填序号);反应进行过程中,关闭该装置中的止水夹a 后,可以观察到的现象是酸液沿长颈漏斗缓缓上升,反应停止
酸液沿长颈漏斗缓缓上升,反应停止
.(3)小明通过查阅资料得知,增大蔬菜大棚里空气中的CO2浓度,可以有效地提高蔬菜的产量.他计划用稀盐酸和石灰石(主要成分是CaCO3,杂质不参与反应)反应,向自家的蔬菜大棚补充CO2.经测算,小明准备向大棚中输入88gCO2,他至少需要10%的稀盐酸多少克?
分析:制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石(主要成分是碳酸钙)和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.反应进行过程中,关闭该装置中的止水夹a 后,使内外产生压强差,可以观察到的现象是:酸液沿长颈漏斗缓缓上升,反应停止;
解答:解:(1)如果用双氧水和二氧化锰制氧气就不需要加热,其中二氧化锰起催化作用;如果用氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;故答案为:2KClO3
2KCl+3O2↑;排水法(或向上排空气法);2H2O2
2H2O+O2↑;催化作用
(2)实验室制取CO2,是在常温下,用大理石和盐酸来制取二氧化碳,因此不需要加热;反应进行过程中,关闭该装置中的止水夹a 后,使内外产生压强差,可以观察到的现象是:酸液沿长颈漏斗缓缓上升,反应停止;故答案为:②③,酸液沿长颈漏斗缓缓上升,反应停止,
(3)设他至少需要10%的稀盐酸的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x?10% 88g
=
x=1460g 答:他至少需要10%的稀盐酸的质量为1460g;
故答案为:1460g
| ||
| △ |
| ||
(2)实验室制取CO2,是在常温下,用大理石和盐酸来制取二氧化碳,因此不需要加热;反应进行过程中,关闭该装置中的止水夹a 后,使内外产生压强差,可以观察到的现象是:酸液沿长颈漏斗缓缓上升,反应停止;故答案为:②③,酸液沿长颈漏斗缓缓上升,反应停止,
(3)设他至少需要10%的稀盐酸的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x?10% 88g
| 73 |
| 44 |
| x?10% |
| 88g |
故答案为:1460g
点评:本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强,有关的计算要准确.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目


 .
. 32、化学兴趣小组同学们在课外活动中设计了如图装置来验证某气体的化学性质.
32、化学兴趣小组同学们在课外活动中设计了如图装置来验证某气体的化学性质. (2)同学们又设计以下实验(如图)研究某混合气体的组成.
(2)同学们又设计以下实验(如图)研究某混合气体的组成.



