题目内容
(2013?江都市二模)(1)关注碳排放 空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉空气中的CO2,如图1所示.
步骤二中发生反应的化学方程式是
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.
①NaOH的溶液喷成雾状是为
②图2a环节中,发生反应的化学方程式为
评价:上述两种方法在化学原理上都是可行的,但在实际应用中仍存在很多问题,例如:方法Ⅰ主要是受到地域和气候的限制;方法Ⅱ主要
(2)电动自行车以轻便、省力、操作简单、节能的优势正日益受到城镇居民的青睐.电动自行车常用铅蓄电池.
①铅酸蓄电池放电时的能量转化形式是
②铅蓄电池中的电解液常用30%~50%的稀硫酸.现欲配制质量分数为40%的稀硫酸400mL(密度为1.30g/cm3),需98%的浓硫酸(密度为1.84g/cm3)
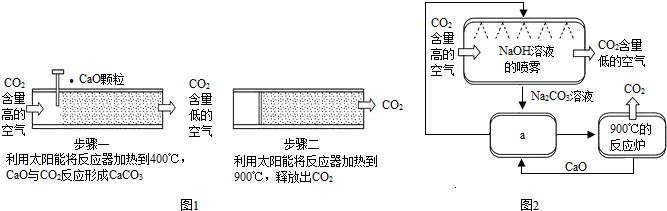
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉空气中的CO2,如图1所示.
步骤二中发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
.
| ||
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.
①NaOH的溶液喷成雾状是为
增大反应物的接触面积(或提高反应速率、提高吸收速率等合理均可)
增大反应物的接触面积(或提高反应速率、提高吸收速率等合理均可)
.②图2a环节中,发生反应的化学方程式为
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
.评价:上述两种方法在化学原理上都是可行的,但在实际应用中仍存在很多问题,例如:方法Ⅰ主要是受到地域和气候的限制;方法Ⅱ主要
能耗太大
能耗太大
.(2)电动自行车以轻便、省力、操作简单、节能的优势正日益受到城镇居民的青睐.电动自行车常用铅蓄电池.
①铅酸蓄电池放电时的能量转化形式是
化学
化学
能转化为电
电
能.②铅蓄电池中的电解液常用30%~50%的稀硫酸.现欲配制质量分数为40%的稀硫酸400mL(密度为1.30g/cm3),需98%的浓硫酸(密度为1.84g/cm3)
115.4
115.4
mL,水307.7
307.7
mL.(保留小数点后一位)
分析:(1)根据题干提供的信息进行分析,反应器中碳酸钙在900℃时能分解生成氧化钙和二氧化碳;NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分,或提高反应速率等;图2a中发生的反应是氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;使用方法Ⅱ吸收二氧化碳消耗的能源太多;
(2)根据能量转化的知识判断;并根据溶液稀释前后溶质质量不变进行计算.
(2)根据能量转化的知识判断;并根据溶液稀释前后溶质质量不变进行计算.
解答:解:(1)方法Ⅰ:碳酸钙在900℃时能分解生成氧化钙和二氧化碳,方程式是CaCO3
CaO+CO2↑;
方法Ⅱ:①烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分提高反应速率,促进反应的进行;
②图2a中发生的反应是氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式是:CaO+H2O═Ca(OH)2、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,使用方法Ⅱ反应炉内要加热到900℃,消耗的能源太多,成本太大;
(2)①铅蓄电池充电时将电能转化为化学能储存起来,放电时是将化学能转化为电能释放出来;
②根据稀释前后溶质质量不变的原理进行计算;
设需要98%的浓硫酸的体积为x
(400ml×1.3g/cm3)×40%=(x×1.84 g/cm3)×98%
x≈115.4ml
需要水的质量为:(400ml×1.3g/cm3)-(115.4ml×1.84 g/cm3)≈307.7g,则水的体积为=
=307.7mL;
故答案为:(1)方法Ⅰ、CaCO3
CaO+CO2↑;
方法Ⅱ、①增大反应物的接触面积(或提高反应速率、提高吸收速率等合理均可);
②CaO+H2O═Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;能耗太大;
(2)①化学;电;②115.4;307.7.
| ||
方法Ⅱ:①烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分提高反应速率,促进反应的进行;
②图2a中发生的反应是氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式是:CaO+H2O═Ca(OH)2、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,使用方法Ⅱ反应炉内要加热到900℃,消耗的能源太多,成本太大;
(2)①铅蓄电池充电时将电能转化为化学能储存起来,放电时是将化学能转化为电能释放出来;
②根据稀释前后溶质质量不变的原理进行计算;
设需要98%的浓硫酸的体积为x
(400ml×1.3g/cm3)×40%=(x×1.84 g/cm3)×98%
x≈115.4ml
需要水的质量为:(400ml×1.3g/cm3)-(115.4ml×1.84 g/cm3)≈307.7g,则水的体积为=
| 307.7g |
| 1.0 g/cm3 |
故答案为:(1)方法Ⅰ、CaCO3
| ||
方法Ⅱ、①增大反应物的接触面积(或提高反应速率、提高吸收速率等合理均可);
②CaO+H2O═Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;能耗太大;
(2)①化学;电;②115.4;307.7.
点评:本题能很好考查学生分析所给信息,并结合相关知识解决问题的能力,解答时可以依据已有的知识结合二氧化碳的性质,以及溶液的稀释进行解答,要细心分析、计算才能得出正确答案.

练习册系列答案
相关题目