题目内容
【题目】(1)比较相同质量的钠、镁、铝三种金属,哪一种所含的原子最多___?哪一种所含的原子最少___?为什么? ___。
(2)碳12原子的质量为1.993×10-26kg,一种铁原子的质量为9.288×10-26kg,计算该铁原子的相对原子质量__________(保留小数点后一位)
【答案】钠 铝 相对原子质量越小,其原子的实际质量越小,所含的原子数越多 55.9
【解析】
(1)钠、镁、铝的相对原子质量分别是23、24、27;元素的相对原子质量与其实际质量成正比,由于相对原子质量的大小关系是钠<镁<铝,所以真实质量也是这一关系,故相同质量的钠、镁、铝三种金属含原子数目的多少关系是:钠>镁>铝.
故答案为:钠;铝;相对原子质量越小,其原子的实际质量越小,所含的原子数越多。
(2)碳12原子的质量为1.993×10-26Kg,一种铁原子的质量为9.288×10-26Kg,则铁原子的相对原子质量为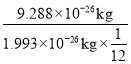 ≈55.9.
≈55.9.
故填:55.9.

练习册系列答案
相关题目