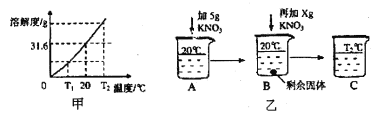
题目内容
【题目】将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示。请回答下列问题:
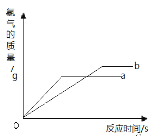
(1)表示锌粉与稀硫酸反应的曲线是: (填 a 或 b)
(2)对于曲线a表示的反应, (填化学式)有剩余。
(3)若有一种金属剩余,则剩余的金属一定是 (填化学式)
【答案】(1)a (2)H2SO4 (3)Fe
【解析】
试题分析:(1)通过观察产生氢气的质量与时间的关系图,可以看出a反应速率更快,从而说明金属a 的活动性更强,故表示锌粉与稀硫酸反应的曲线是:a
(2)由于曲线a 表示的是锌粉与稀硫酸反应的曲线,等质量的锌粉和铁粉,锌消耗的H2SO4质量更小,故对于锌来说,H2SO4有剩余
(3)根据反应:Zn + H2SO4 === ZnSO4 + H2↑中Zn与H2SO4的质量关系为65:98,而反应:Fe + H2SO4 === FeSO4 + H2↑中Fe与H2SO4的质量关系为56:98,,故相同质量的H2SO4,消耗Zn的质量更多,故若有一种金属剩余,则剩余的金属一定是Fe

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目