题目内容
【题目】下列遵守质量守恒定律的是
A.10g冰加热变为10g水
B.水电解时,产生20毫升氢气和10毫升氧气
C.8g硫与8g氧气反应生成16g二氧化硫
D.8g硫与9g氧气反应生成17g二氧化硫
【答案】C
【解析】
试题分析:质量守恒定律适用的范围为一切化学变化的质量变化,A.10g冰加热变为10g水,是物理变化,不遵守质量守恒定律;B.水电解时,产生20毫升氢气和10毫升氧气,是化学变化,物理量不是质量,体积的关系不遵守质量守恒定律;C.8g硫与8g氧气反应生成16g二氧化硫,是化学变化遵守质量守恒定律; D.8g硫与9g氧气反应生成17g二氧化硫,是化学变化氧气有剩余不遵守质量守恒定律;故答案选择A

【题目】我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动
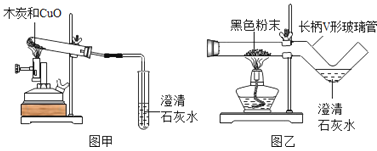
【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】
(1)木炭与CuO的反应是:C+2CuO![]() 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③ .
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水 ,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
步骤 | 现象 | 结论 |
①取1.44g红色固体装入试管,滴入足量的 ,充分反应 | 红色固体部分减少,溶为变 为 色 | 猜想 错误 |
②滤了试管中残留的红色固体,洗涤干燥,称其质量为1.04g | / | 猜想 正确 |
【评价反思】
(1)使用图乙装置与使用图甲装置相比,其优点是 (写出1条即可).
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的 .
(3)在铜的冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”,该方法可用化学方程式表示 .