题目内容
【题目】小王同学想测定某Cu﹣Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示.请完成下列分析及计算: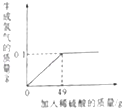
(1)反应生成氢气的总质量为g.
(2)计算合金中铜的质量分数.
【答案】
(1)0.1
(2)
设该合金中锌的质量为x
Zn+2H2SO4═Zn SO4+H2↑
65 2
x 0.1g
![]()
x=3.25g
合金中铜的质量分数= ![]() 100%=75%,
100%=75%,
答:合金中铜的质量分数为75%.
【解析】(1)由图可知,完全反应后生成氢气的质量为0.1g.
(1)根据图中的信息可知氢气的质量.(2)利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,进而求出黄铜中铜的质量分数.本题考查根据化学方程式的简单计算,已知生成物的质量求反应物的质量,解题的关键是正确的对图象意义的分析.

练习册系列答案
相关题目




