题目内容
25、(1)将金属铬与镁、铁分别放入到溶质质量分数相同的稀盐酸中,其反应现象如下:

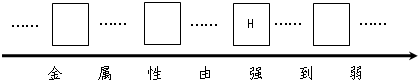
①三种金属的活动性由强到弱的顺序
②某同学推测:“铬金属活动性一定比铝强.”你认为是否正?
③要比较铬与锌的金属活动性强弱,实验方法是
(2)实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现用20g溶质质量分数为15%的硝酸钾溶液来进行配制,还需硝酸钾晶体

①三种金属的活动性由强到弱的顺序
镁>铬>铁
.②某同学推测:“铬金属活动性一定比铝强.”你认为是否正?
不正确
.③要比较铬与锌的金属活动性强弱,实验方法是
取锌片和铬片分别放入质质量分数相同的稀盐酸中,观察产生气泡的速度
.(2)实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现用20g溶质质量分数为15%的硝酸钾溶液来进行配制,还需硝酸钾晶体
7g
g和蒸馏水23g
g.分析:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,进行溶液配制时要根据溶质质量分数进行有关的计算.
解答:解:(1)①根据金属与酸反应产生气泡的速度可以看出,这三种金属中镁最活泼,其次是铬,最弱的是铁,所以本题答案为:镁>铬>铁;
②在金属活动性顺序中,镁>铝,此时推测铬金属活动性一定比铝强是不正确的,所以本题答案为:不正确;
③要比较铬与锌的金属活动性强弱,可以根据金属与酸的反应速度进行判断,设计实验时要注意控制变量,保证金属的颗粒大小和酸相同,所以本题答案为:取锌片和铬片分别放入质质量分数相同的稀盐酸中,观察产生气泡的速度.
(2)配制50g溶质质量分数为20%的硝酸钾溶液,需要硝酸钾的质量为50g×20%=10g,用20g溶质质量分数为15%的硝酸钾溶液来进行配制,则已有硝酸钾的质量为20g×15%=3g,已有水的质量为20g-3g=17g,还需要硝酸钾的质量为10g-3g=7g,需要水的质量为40g-17g=23g,所以本题答案为:7g,23g.
②在金属活动性顺序中,镁>铝,此时推测铬金属活动性一定比铝强是不正确的,所以本题答案为:不正确;
③要比较铬与锌的金属活动性强弱,可以根据金属与酸的反应速度进行判断,设计实验时要注意控制变量,保证金属的颗粒大小和酸相同,所以本题答案为:取锌片和铬片分别放入质质量分数相同的稀盐酸中,观察产生气泡的速度.
(2)配制50g溶质质量分数为20%的硝酸钾溶液,需要硝酸钾的质量为50g×20%=10g,用20g溶质质量分数为15%的硝酸钾溶液来进行配制,则已有硝酸钾的质量为20g×15%=3g,已有水的质量为20g-3g=17g,还需要硝酸钾的质量为10g-3g=7g,需要水的质量为40g-17g=23g,所以本题答案为:7g,23g.
点评:本题考查了金属活动性顺序的应用以及溶液的有关计算,完成此题,可以依据金属活动性顺序的意义及溶质质量分数公式进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(1)将金属铬与镁、铁分别放入到溶质质量分数相同的稀盐酸中,其反应现象如下:
| 金属 | Cr(铬) | Mg | Fe |
| 反应现象 | 较多气泡 | 大量气泡 | 较少气泡 |
②某同学推测:“铬金属活动性一定比铝强.”你认为是否正?________.
③要比较铬与锌的金属活动性强弱,实验方法是________.
(2)实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现用20g溶质质量分数为15%的硝酸钾溶液来进行配制,还需硝酸钾晶体________g和蒸馏水________g.
(2010?昆明模拟)(1)将金属铬与镁、铁分别放入到溶质质量分数相同的稀盐酸中,其反应现象如下:
①三种金属的活动性由强到弱的顺序.
②某同学推测:“铬金属活动性一定比铝强.”你认为是否正?.
③要比较铬与锌的金属活动性强弱,实验方法是.
(2)实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现用20g溶质质量分数为15%的硝酸钾溶液来进行配制,还需硝酸钾晶体g和蒸馏水g.
| 金属 | Cr(铬) | Mg | Fe |
| 反应现象 | 较多气泡 | 大量气泡 | 较少气泡 |
②某同学推测:“铬金属活动性一定比铝强.”你认为是否正?.
③要比较铬与锌的金属活动性强弱,实验方法是.
(2)实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现用20g溶质质量分数为15%的硝酸钾溶液来进行配制,还需硝酸钾晶体g和蒸馏水g.