题目内容
(5分)金属资源属于不可再生资源。某同学用同规格且光亮洁净无锈的铁钉进行了如下图所示实验。
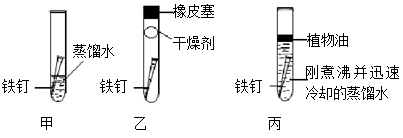
(1)一段时间后,铁钉表面生锈的是 (填“甲”、“乙”或“丙”);由此可知,铁制品生锈的条件是__________________________________________。
(2)实验丙中为什么要用“刚煮沸并迅速冷却的蒸馏水”?______________________。
(3)为了防止铁制品进一步锈蚀,应将铁锈立即清除,可用稀盐酸除锈(铁锈主要成分为Fe2O3),其反应的化学方程式为________________________________________。

(1)一段时间后,铁钉表面生锈的是 (填“甲”、“乙”或“丙”);由此可知,铁制品生锈的条件是__________________________________________。
(2)实验丙中为什么要用“刚煮沸并迅速冷却的蒸馏水”?______________________。
(3)为了防止铁制品进一步锈蚀,应将铁锈立即清除,可用稀盐酸除锈(铁锈主要成分为Fe2O3),其反应的化学方程式为________________________________________。
(1)甲 铁与水和氧气共同作用
(2)除去水中溶解的氧气,使铁不能与氧气接触
 (3)Fe2O3 + 6HCl 2FeCl3 + 3H2O
(3)Fe2O3 + 6HCl 2FeCl3 + 3H2O
(2)除去水中溶解的氧气,使铁不能与氧气接触
 (3)Fe2O3 + 6HCl 2FeCl3 + 3H2O
(3)Fe2O3 + 6HCl 2FeCl3 + 3H2O:(1)甲中铁钉与空气和水共同接触,乙中没有水,丙中没有氧气,故甲表面生锈,铁生锈的条件是:与氧气接触,有水参加,二者缺一不可;
(2)实验丙中用“刚煮沸并迅速冷却的蒸馏水”是为了探究铁只与水接触没有氧气不能生锈;
(3)氧化铁与盐酸反应生成氯化铁和水,化学方程式为:Fe2O3 +6HCl=2FeCl3+3H2O
故答案为:
(1)甲铁与水和氧气共同作用.
(2)除去水中溶解的氧气,使铁不能与氧气接触.
(3)Fe2O3 +6HCl=2FeCl3+3H2O.
(2)实验丙中用“刚煮沸并迅速冷却的蒸馏水”是为了探究铁只与水接触没有氧气不能生锈;
(3)氧化铁与盐酸反应生成氯化铁和水,化学方程式为:Fe2O3 +6HCl=2FeCl3+3H2O
故答案为:
(1)甲铁与水和氧气共同作用.
(2)除去水中溶解的氧气,使铁不能与氧气接触.
(3)Fe2O3 +6HCl=2FeCl3+3H2O.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目